2023-2024 н.р.
Хімія 10-А
https://meet.google.com/kyf-hwgs-pzp - посилання на онлайн уроки (за розкладом)
06.05.02024 - (08/05/02024)
Тема: 1. Синтетичні високомолекулярні речовини. Полімери. Пластмаси. Каучуки. Гума.
2. Вплив полімерних матеріалів на здоров'я людини. Проблема утилізації полімерів і пластмас. Синтетичні волокна.
https://youtu.be/itAbG9lftvA
https://youtu.be/8jE3tGIMtMw - полімери
https://youtu.be/FDLSmJUusEE - пластмаси, каучук, гума
https://youtu.be/xSMksk2rxJ0 - каучук, гума
https://youtu.be/HkXjC4cweUw - вплив полімерів на їдоров'я
https://youtu.be/sDDvimSw7vE - синтетичні волокна
Д.З. опрацювати матеріал підручника, сайту, відео. Скласти конспект.
24.04.2024
Тема: Насичені і ароматичні аміни: склад, будова молекули, назви найпростіших сполук. Будова аміногрупи. Аміни як органічні основи. Хімічні властивості метанаміну, аніліну. Одержання аніліну.
https://youtu.be/Ru19DPLIXyQ - насичені аміни
https://youtu.be/P89aXysUN3w - анілін
Склад і будова молекул амінів. Вам уже відомо, що Нітроген в органічних сполуках міститься не тільки в структурі карбонового ланцюга, а й у складі характеристичних (функціональних) груп, зокрема аміногрупи.
• Аміни — органічні сполуки, до складу молекул яких входить характеристична (функціональна) аміногрупа -NH2.
За будовою молекул аміни — похідні амоніаку, у молекулі якого один або кілька атомів Гідрогену заміщені на алкільні (вуглеводневі) радикали. Наприклад, якщо в молекулі амоніаку один атом Гідрогену заміщений на алкільну групу -СН3, то утворюється метанамін (метиламін), якщо ж наявна алкільна група -С2Н5 — етанамін (етиламін). Їхні структурні формули відповідно

Так утворюються найпростіші за складом і будовою речовини, які називають первинними амінами.
У разі заміщення двох атомів Гідрогену утворюються вторинні аміни — диметиламін, а якщо заміщені всі три атоми — третинні (триметиламін). Їхні структурні формули відповідно такі:

Характеристична група цього класу сполук -NH2, вона ж визначатиме їхні властивості.
В амінів валентні кути становлять 106-108°. Будову молекули метанаміну (метиламіну) зображено на рис.

Рис. Схема будови молекули метанаміну (метиламіну)
Із рис. бачимо, що в аміногрупі амінів наявна неподілена електронна пара, яка впливає на властивості цих сполук. Зокрема, вони вступають у хімічну взаємодію з кислотами (див. хімічні властивості)
Назви найпростіших за складом амінів. До найпростіших за складом амінів належать первинні аміни, склад молекул яких відображає загальна формула R-NH2, де R — алкільна група (вуглеводневий радикал). Назви цих сполук походять від назв відповідних алканів із додаванням слова -амін.

Рис. Схема побудови назв первинних амінів
Ознайомтеся із структурними формулами первинних насичених амінів та їхніми назвами за систематичною номенклатурою.
CH3-NH2 | метанамін |
CH3-CH2-NH2 | етанамін |
CH3-CH2-CH2-NH2 | пропан-1-амін |
CH3-CH2-CH2-CH2-NH2 | бутан-1-амін |
CH3-CH2-CH2-CH2-CH2-NH2 | пентан-1-амін |
Із структурних формул робимо висновок, що в наведених амінів аміногрупа розміщується біля першого атома Карбону. Тому, починаючи з третього представника, указуємо її положення.
Моделі молекули метанаміну зображено на рис.

Рис. Кулестержнева (а) і масштабна (б) моделі молекули метанаміну
Хімічні властивості метанаміну. Для метанаміну властиві реакції горіння, взаємодії з водою та хлоридною кислотою
Реакції окиснення. Метанамін горить у повітрі з утворенням карбоп(ІV) оксиду, води та азоту. Рівняння реакції:
4CH3-NH2 + 9О2 → 4СО2 + 10Н2О + 2N2.
Взаємодія з водою. Метанамін добре взаємодіє з водою, унаслідок чого утворюється метанамоній гідроксид. Продукт реакції забарвлює розчин фенолфталеїну в малиновий колір.
Пригадайте, у якому середовищі — кислотному, лужному чи нейтральному — індикатор фенолфталеїн змінює забарвлення на малинове.
Отже, розчин метанаміну проявляє лужні властивості. Рівняння реакції:
![]()
Взаємодія з хлоридною кислотою. Як і з водою, метанамін реагує з хлоридною кислотою за положенням неподіленої електронної пари. Рівняння реакції:
![]()
Взаємодії метанаміну з водою та хлоридною кислотою підтверджують основні властивості амінів. Отже, аміни — органічні основи.
Ароматичні аміни. Анілін. Ароматичні аміни утворюються, якщо в молекулі бензену один атом Гідрогену заміщується на аміногрупу. Найпростішим ароматичним аміном є анілін, склад молекули якого відображає молекулярна формула C6H5-NH2. Будову молекули аніліну показано на рис.

Рис. Склад і будова молекули аніліну (феніламіну)
Розглянувши рис. 46, зробимо висновок, що в молекулі аніліну, так само як і в насичених амінів, аміногрупа містить неподілену електронну пару. Тому можна припустити, що анілін проявлятиме властивості органічних основ. Крім того, наявність ароматичної групи атомів -С6Н5 впливає на властивості аміногрупи. У молекулі аніліну наявний взаємний вплив атомів, зокрема бензенове кільце впливає на аміногрупу й навпаки. Це визначає хімічні властивості речовини. Масштабну модель молекули аніліну зображено на рис.

Рис. Масштабна модель молекули аніліну
Хімічні властивості аніліну. Якщо подіяти на анілін розчином фенолфталеїну, то зміна забарвлення не спостерігається. Це означає, що анілін як основа слабший за насичені аміни.
Під час реакцій із кислотами анілін за положенням неподіленої електронної пари приєднує йон Гідрогену. Проведемо віртуальний дослід і спостерігатимемо, чи взаємодіє анілін із хлоридною кислотою. Очевидно, що анілін реагує з кислотою. Продуктом реакції є сіль — феніламоній хлорид. Рівняння реакції:
![]()
Вплив аміногрупи на бензенове кільце проявляється в реакції з бромом. Проведемо знову віртуальний дослід і спостерігатимемо, чи реагує анілін з бромною водою. Випадання білого осаду свідчить про перебіг реакції. Рівняння реакції:

Унаслідок реакції утворюється 2,4,6-трибромоанілін. Отже, якщо бензен не реагує з бромною водою, то анілін завдяки впливу аміногрупи заміщує атоми Гідрогену в положеннях 2, 4, 6.
Добування аніліну. Синтез аніліну вперше здійснив російський хімік М. Зінін у 1842 р. Реакція відновлення нітробензену відбувається за наявності каталізатора та температури 250-300 °С. Рівняння реакції:

З відкриттям цього синтезу розпочалося промислове виробництво аніліну, що є незамінною сировиною для добування багатьох органічних речовин, зокрема анілінових барвників і лікувальних засобів. Це потребує великої кількості аніліну. Тому його добувають з бензену, який отримують під час коксування кам'яного вугілля. Процес відбувається за таким ланцюжком перетворень:

Вплив аніліну та його похідних на довкілля й організм людини. Анілін — речовина, на основі якої виникла та розвинулась анілінофарбова промисловість. Оскільки анілін є дуже отруйною речовиною, то й усі барвники на його основі також токсичні. Часто барвники, що їх використовують у текстильній і шкіряній промисловості, разом з відходами потрапляють у стічні води й ґрунти, а випаровуючись, отруюють повітря. Разом із барвниками в навколишнє середовище потрапляють кислоти й луги. Усе загалом несприятливо впливає на організм людини, викликаючи захворювання верхніх дихальних шляхів, алергічні реакції.
Анілін застосовують у виробництві багатьох лікувальних засобів (сульфаніламідні препарати), ця речовина діє як знеболювальне та має здатність знижувати температуру тіла.
ЦІКАВО ЗНАТИ
• Hа основі аніліну виробляють анілінові барвники. Так, барвник «аніліновий чорний» одержують окисненням аніліну хромовою сумішшю (K2Cr2O7 + H2SO4). Цей барвник використовують для фарбування тканин.
• Анілін — отруйна речовина, що негативно впливає на здоров'я людини. В організм потрапляє під час дихання, крізь шкіру та слизові оболонки. Унаслідок потрапляння аніліну в кров змінюється функція еритроцитів, починається кисневе голодування, порушується робота внутрішніх органів; уражає центральну нервову систему. Хронічне отруєння аніліном спричиняє токсичний гепатит, нервово-психічні розлади, погіршення пам'яті тощо.
Д.З. опрацювати матеріал підручника, сайту, відео.
10.04.2023 - 15.04.2023
Тема: Розв'язок задач на обчислення за хімічними рівняннями кількості речовини, маси або об'єму за кількістю речовини, що містить певну кількість домішок.
https://youtu.be/wyxMMb6gIgw
Задача 1. Кальцій карбід масою 160 г з масовою часткою домішок 20 % прореагував з водою. Обчисліть об'єм газу (н. у.), що утворився. Назвіть газ.

Задача 2. Етанол масою 230 г піддали окисненню в присутності каталізатора. Утворилася етанова кислота кількістю речовини 4 моль. Обчисліть масову частку домішок у реагенті.

Задача 3. Під час термічного розкладу метану об'ємом 1 м3 утворився етин об'ємом 480 л (н. у.). Обчисліть об'ємну частку домішок у метані та об'єм водню, що виділився при цьому.

ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
- 1. Етен масою 2,8 г вступив у реакцію з бромом. Утворився продукт масою 18 г. Обчисліть масову частку домішок в етені.
- 2. З природного газу об'ємом 2 м3, що містить метан з масовою часткою домішок 20 %, добули етин. Обчисліть об'єм етину (н. у.), що утворився.
08.04.2024
Тема: Практична робота "Розв'язування експериментальних задач"
https://youtu.be/4G9sYWBkk00
Перегляньте відео практичної роботи. Оформити роботу у вигляді таблиці, описати досліди, записати рівняння реакції, зробити висновок по роботі.
///////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////
17.01.2024 - 22.01.2024
Тема: Методи одержання вуглеводнів. Застосування вуглеводнів.
https://youtu.be/B365suarFKk
Перегляньте відео. Повторіть матеріал підручника п. 5-12 і матеріали сайту.
15.01.2024
Тема: Ненасичені вуглеводні. Арени. Бензен.
https://youtu.be/0_iZQblkFi8
https://youtu.be/xmn6-R1yhME
Особливу групу серед циклічних складають арени (ароматичні) сполуки. Загальна формула ароматичних вуглеводнів —
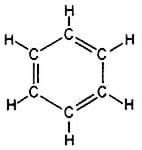
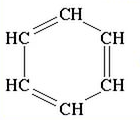
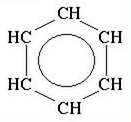
Використовують також скелетні формули бензолу, в яких не вказані атоми Карбону:
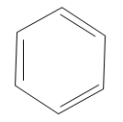
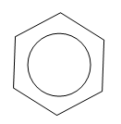
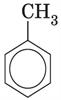 ;
;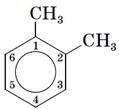 ;
;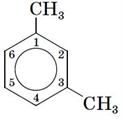 .
.Перегляньте відеоматеріали. Опрацюйте матеріал підручника п. 9,10,11.
Немає коментарів:
Дописати коментар