05.05.2021
Тема: Синтетичні високомолекулярні ркчовини. Полімери. Пласмаси. Каучуки. Гума.
В основі створення новітніх матеріалів лежать високомолекулярні сполуки — полімери.
Полімери — природні та штучні сполуки, молекули яких складаються з великого числа повторюваних однакових або різних за будовою атомних угруповань, сполучених між собою в довгі лінійні або розгалужені ланцюги.
Полімеризація — це послідовне сполучення однакових молекул низькомолекулярної речовини з утворенням високомолекулярної речовини.
Поліконденсація — це процес утворення високомолекулярних сполук з низькомолекулярних, що зазвичай супроводжується виділенням побічних речовин (води, амоніаку, хлороводню тощо).
https://www.youtube.com/watch?v=59OywMPydhU
Опрацювати п. 30 - 34, ст. 203-204
28.04.2021
Тема: Закріплення знань про оксигеновмісні органічні сполуки.
1.
Які
нітрогеновмісні сполуки ви знаєте?
2. Серед наведених формул укажіть ті, які
належать амінам, назвіть ці речовини:
вкажіть первинні, вторинні та третинні аміни, аліфатичні та ароматичні аміни:
1)С3Н7NН2, 2)С3Н6, 3) С5Н11Сl, 4) СН3-NH –CH3, 5) СН3-N –CH3 ,
6) С6Н5NН2, 7)СН3ОН, 8)СН3 –NО2, 9)С2Н5NН2. │
CН3
3. Серед
наведених формул укажіть ті, які належать
амінокислотам, назвіть ці речовини:
1).CH3 - CH2 - NH2 ; 2). CH3
- CH2 – COOH; 3). СН3 – СН – СН2
- СООН
4) СН2 – СН2
– СН2 -СООН │
│ NH2
NН2
4. Які хімічні властивості виявляють аміни?
5. Які хімічні властивості виявляють амінокислоти?
6. Які функціональні групи входять
до складу амінокислот?
7.
Які властивості
зумовлює карбоксильна група?
8.
Які властивості зумовлює
аміногрупа?
9.
Чому амінокислоти називають амфотерними сполуками?
10.
Який зв’язок утворюється при взаємодії амінокислот одна з
одною? (пептидний)
11.
Що утворюється в результаті реакції поліконденсації
α-амінокислот? (поліпептиди).
12.
Які сполуки
називаються білками?
13.
Які структури
мають молекули білків? Змоделюйте структури білка , використовуючи дріт.
14. Що таке НК ?
15. Які види нуклеїнових кислот ви
знаєте?
16. Що є мономером природних полімерів - нуклеїнових
кислот?
17. З чого складається нуклеотид?
18. Що спільного мають нуклеотиди ДНК і РНК?
19. Чім відмінні нуклеотиди ДНК і РНК?
20. Що таке реплікація? Яка роль цього
процесу?
21. Яка біологічна роль ДНК?
22. Яка біологічна роль РНК
Виконання індивідуальних завдань
1.
Здійснити перетворення:
СН4 → С2Н2
→ СН3СНО → СН3СООН → СН2СООН→ СН2СООН
↓ │ │
C6H6 → C6H5Cl → C6H5NH2 Cl NН2
2.
Який об’єм
кисню потрібний для спалювання 90г етиламіну?
90г хл
4С2Н5NН2
+ 15О2 → 8СО2 +14Н2О
+ 2N2
4∙45г 15∙22,4л
Х = 168л
3.Під час відновлення
нітробензену добули 82,77г аніліну. Який об’єм водню використали для реакції,
якщо вихід продукту реакції становить 89% від теоретичного?
Хл 93г
![]() С6Н5NО2
+ 3H2 Fe,
HCl С6Н5NН2
+ 2H2O
С6Н5NО2
+ 3H2 Fe,
HCl С6Н5NН2
+ 2H2O
3∙22,4л 93г
1)
m(С6Н5NН2)теор. = 82,77: 0,89 = 93г
2)
V(Н2) = 67,2л.
Повторити п. 26-29
21.04.2021
Тема: Насичені і ароматичні аміни. Амінокислоти. Білки.
ПОНЯТТЯ ПРО АМІНИ, ЇХ СКЛАД І БУДОВУ. За якісним складом — це нітрогеновмісні органічні сполуки, молекули яких містять атоми Карбону, Гідрогену й Нітрогену. Карбон входить до складу вуглеводневого залишку, Нітроген — до складу характеристичної аміногрупи —NH2, Гідроген — до обох складових частин молекули. Назва «аміни» утворена від назви «амоніак». Цей клас сполук розглядають як похідні амоніаку NH3, у молекулі якого один, два або три атоми Гідрогену заміщені вуглеводневими залишками, наприклад, метанамін СН3—NH2, метилметанамін (СН3)2 — NH, диметилметанамін (СН3)3 — N. У всіх амінів, подібно до амоніаку, в атома Нітрогену є вільна електронна пара.
![]()
Завдяки вільній електронній парі аміни вступають у реакції з водою й кислотами.
Аміни — нітрогеновмісні органічні речовини, похідні амоніаку, молекули яких складаються з вуглеводневого залишку й характеристичної аміногрупи —NH2.
У разі наявності в молекулі аміну двох вуглеводневих залишків, у складі характеристичної групи залишається один атом Гідрогену. Якщо вуглеводневих залишків три, то Гідроген у характеристичній групі відсутній.
КЛАСИФІКАЦІЇ Й ЗАГАЛЬНІ ФОРМУЛИ АМІНІВ. Залежно від природи вуглеводневих замісників розрізняють насичені аміни (аміногрупа сполучена із залишком алкану) й ароматичні аміни (аміногрупа сполучена із залишком арену), наприклад:

Кількість вуглеводневих залишків у молекулі служить ще однією класифікаційною характеристикою амінів, за якою їх поділяють на первинні, вторинні й третинні:

Зображені формули є загальними формулами насичених амінів.
НОМЕНКЛАТУРА НАСИЧЕНИХ ПЕРВИННИХ АМІНІВ, ІЗОМЕРІЯ. За систематичною номенклатурою назва аміну складається з одного слова. Воно починається з повної назви відповідного алкану, а до неї додається назва класу сполук «амін». Наприклад:
CH3NH2 — метанамін;
CH3CH2NH2 — етанамін.
Для того щоб назвати насичений первинний амін з розгалуженим вуглеводневим замісником, дотримуються таких правил.
1. Обирають головний (найдовший) карбоновий ланцюг, у якому один з атомів Карбону сполучений з аміногрупою.
2. Нумерують головний ланцюг за принципом найменшого локанта аміногрупи.
3. З'ясовують наявність у головному ланцюзі вуглеводневих замісників і їх назви.
4. Складають назву речовини в такій послідовності:
- називають в алфавітному порядку вуглеводневі замісники (у разі їх наявності в головному ланцюзі), указуючи перед назвами їх локанти, які виділяють дефісами. До однакових замісників уживають множинні префікси ди-, три-, тетра-;
- називають алкан головного ланцюга;
- після назви головного ланцюга записують, виділяючи з обох боків дефісами, локант аміногрупи;
- додають назву класу цих сполук — «амін».
Наприклад, за систематичною номенклатурою амін зі структурною формулою

має назву 3-етил-4-метилгексан-1-амін.
Попрацюйте групами
1. Опануйте правила номенклатури насичених первинних амінів, скориставшись розглянутою вище структурною формулою аміну та його назвою.
2. Назвіть амін, формула якого:

3. Складіть формулу 4,5-диметил-3-пропілоктан-2-аміну.
Вторинні й третинні аміни симетричної будови прийнято називати так:

ІЗОМЕРІЯ НАСИЧЕНИХ ПЕРВИННИХ АМІНІВ. Як ви вже зрозуміли з виконаних у групі завдань, номенклатура цих сполук залежить від будови карбонового ланцюга та місця розташування аміногрупи. Закономірно, що аміни мають більше ізомерів, ніж відповідні їм алкани. Наприклад, у бутану один ізомер, у бутанаміну — три.
Складіть самостійно формули ізомерних амінів бутанаміну.
ФІЗИЧНІ ВЛАСТИВОСТІ ДЕЯКИХ АМІНІВ. За звичайних умов метанамін, метилметанамін і диметилметанамін — гази із запахом амоніаку. Аміни з умістом атомів Карбону С4 - С15 — рідини із запахом оселедцю, решта — тверді речовини без запаху.
ХІМІЧНІ ВЛАСТИВОСТІ НАСИЧЕНИХ АМІНІВ НА ПРИКЛАДІ МЕТАНАМІНУ.
1. Горіння амінів. Аміни згорають у повітрі з утворенням азоту, карбон(IV) оксиду та води:
4CH3NH2 + 9O2 → 4CO2 + 10H2O + 2N2
2. Взаємодія з водою. Подібно до амоніаку, розчинні у воді аміни виявляють основні властивості. Так, під час реакції з водою до аміну приєднується протон Н+ і вивільнюється аніон ОН-, утворений унаслідок електролітичної дисоціації води. Це відбувається за рахунок вільної електронної пари атома Нітрогену:

Варто зазначити, що метанамін є сильнішою основою, ніж амоній гідроксид NH4OH. І в цьому разі підтверджується положення теорії будови органічних сполук про взаємний вплив атомів і груп атомів у молекулі.
3. Взаємодія з хлоридною кислотою. Ця взаємодія також базується на приєднанні протону від кислоти до вільної пари електронів атома Нітрогену:

Метанамоній хлорид належить до солей.
Водні розчини амінів містять у надлишку гідроксид-аніони ОН- і мають лужне середовище. Завдяки цьому та здатності утворювати солі з неорганічними кислотами їх називають органічними основами.
Властивості амінів як основ залежать від природи вуглеводневого залишку. Насичені первинні аміни — найсильніші основи серед амінів.
АНІЛІН, АБО ФЕНІЛАМІН. Це ароматичний амін з молекулярною формулою C6H5NH2.
Його називають феніламін за назвою замісника —С6Н5. Молекулярна формула цієї речовини вказує на те, що аміногрупа сполучена з атомом Карбону бензенового кільця (у бензені відбулася заміна одного атома Гідрогену на одновалентну аміногрупу).
Анілін (мал. 34) — безбарвна (темніє на світлі й у повітрі) оліїста речовина, що важко розчиняється у воді, має специфічний запах. Пари аніліну отруйні.

Мал. 34. Анілін
ХІМІЧНІ ВЛАСТИВОСТІ АНІЛІНУ. Порівняно з метанаміном анілін дуже слабка основа, що не діє на індикатори.
Для аніліну характерні дві групи реакцій: за участю аміногрупи (приклад 1) і за участю бензенового кільця (приклад 2).
1. Взаємодія аніліну з хлоридною кислотою.
![]()
2. Взаємодія аніліну з бромною водою. Вам відомо, що бензен не реагує з бромною водою. Але подібно до фенолу анілін за участю бензенового кільця вступає в реакцію заміщення з бромною водою, внаслідок чого утворюється 2,4,6-трибромоанілін (2,4,6-трибромофеніламін) — жовтувато-білий осад (мал. 35).

Мал. 35. Ілюстрація взаємодії аніліну з бромною водою
Заміщення Гідрогену бензенового кільця в трьох положеннях є результатом впливу аміногрупи на бензенове кільце.
ДОБУВАННЯ АНІЛІНУ. У промисловості анілін добувають відновленням нітробензену С6Н5 — NO2 за допомогою водню у присутності нікелевого чи мідного каталізаторів за нагрівання:
![]()
Нітробензен добувають з бензену. Нижче наведено схему цих перетворень:

ЗАСТОСУВАННЯ АНІЛІНУ. Понад 150 років анілін виробляють у великій кількості, тому що ця речовина — основа синтезу анілінових барвників, які використовують для фарбування тканин у різні яскраві кольори (мал. 36).

Мал. 36. Анілінові барвники
Анілінові барвники можна придбати у вигляді порошку або рідини й за потреби використати в домашніх умовах.
Водночас у разі перевищення допустимих норм використання, вплив аніліну та його похідних для довкілля негативний.
Анілін — сировина для синтезу ліків, наприклад стрептоциду, який має ефективну антимікробну дію; фунгіцидів (препаратів для боротьби з грибковими захворюваннями рослин) та ін.
Стисло про основне
• Аміни — похідні амоніаку, у молекулах яких атоми Гідрогену заміщені вуглеводневими залишками.
• Аміногрупа NH2 — характеристична група амінів.
• Залежно від замісника аміни бувають насиченими й ароматичними, а від кількості заміщених в амоніаці атомів Гідрогену — первинні, вторинні й третинні.
• Водні розчини амінів мають лужну реакцію і взаємодіють з неорганічними кислотами. Через це їх ще називають органічними основами.
• Анілін — ароматичний амін. Взаємний вплив бензенового кільця й аміногрупи виявляється в тому, що ця речовина взаємодіє з бромною водою, відбувається заміщенням трьох атомів Гідрогену з утворенням 2,4,6-трибромофеніламіну.
• Анілін у великих кількостях виробляють з нітробензену (його одержують з бензену) й використовують у виробництві барвників, лікарських засобів тощо.
СКЛАД І БУДОВА МОЛЕКУЛ АМІНОКИСЛОТ. З молекулярної формули аміноетанової кислоти C2H5O2N можна дізнатися лише про кількісний та якісний склад її молекул і зробити висновок, що це нітрогеновмісна органічна сполука. Молекулярними формулами амінокислот користуються рідко.
Назва класу амінокислот відображає наявність у молекулі речовин аміногрупи NH2 (характеристична група амінів) і карбоксильної групи (характеристична група карбонових кислот). Напівструктурна формула аміноетанової кислоти NH2—CH2—COOH підтверджує це.
Подовжуючи карбоновий ланцюг та розміщуючи аміногрупу біля різних атомів Карбону або записуючи кілька аміногруп чи карбоксильних груп, дістанемо формули різних амінокислот. У природі їх існує понад 100.
Амінокислоти — це органічні кислоти, що містять одну чи кілька аміногруп. Наявність у молекулах амінокислот аміногрупи —NH2 та карбоксильної групи —COOH визначає їхні властивості як амінів і кислот. Загальна напівструктурна формула амінокислот:
NH2—(CH2)n—COOH.
Побудуємо гомологічний ряд моноамінокарбонових кислот — похідних насичених одноосновних карбонових кислот (табл. 12).
Таблиця 12
Карбонова кислота | Амінокислота | Напівструктурна формула амінокислоти |
Етанова | Аміноетанова | NH2—CH2—COOH |
Пропанова | Амінопропанова | NH2—CH2—CH2—COOH або NH2—(CH2)2—COOH |
Бутанова | Амінобутанова | NH2—CH2—CH2—CH2—COOH або NH2—(CH2)3—COOH |
Пентанова | Амінопентанова | NH2—CH2—CH2—CH2—CH2—COOH або NH2—(CH2)4—COOH |
Гексанова | Аміногексанова | NH2—CH2—CH2—CH2—CH2—CH2—COOH або NH2—(CH2)5—COOH |
Структурні формули амінокислот у таблиці 12 складено таким чином, що аміногрупа розміщена на протилежному від карбоксильної групи кінці ланцюга атомів Карбону. Але вона може бути й біля інших його атомів. Що довшим є ланцюг, то більше можливих положень в аміногрупи. До того ж, сам карбоновий ланцюг буває не лише лінійним, а й розгалуженим.
У таблиці 12 у назвах амінокислот не зазначено положення аміногрупи, тому кожен з вас може за назвою «амінопентанова кислота» скласти ще чотири формули. Ось чому важливо знати й використовувати систематичну номенклатуру амінокислот.
Попрацюйте з таблицею 12 і переконайтеся, що всі амінокислоти названі з додаванням префіксу «аміно» до назви відповідної карбонової кислоти. Наведіть власні приклади.
СИСТЕМАТИЧНА НОМЕНКЛАТУРА АМІНОКИСЛОТ. В аміноетановій кислоті немає потреби вказувати локант аміногрупи, тому що вуглеводневий залишок має лише один атом Карбону. Починаючи з амінопропанової кислоти, з'являються ізомери — аміногрупа може розташовуватись біля різних атомів Карбону. Щоб правильно назвати речовини, знадобляться наведені нижче правила систематичної номенклатури амінокислот.
1. Обирають головний ланцюг кислоти, його нумерацію розпочинають з атома Карбону карбоксильної групи. (Наявні в карбоновому ланцюзі вуглеводневі замісники на порядок нумерації ланцюга не впливають.)
2. У назві речовини перед префіксом «аміно» записують локант (локанти) аміногрупи (аміногруп, якщо їх кілька).
3. Складаючи назву амінокислоти, вуглеводневі залишки та аміногрупу називають в алфавітному порядку.
α-Амінокислоти (інформацію про них наведено на «Сторінці ерудита») є мономерами білкових молекул. Аміноетанова кислота (гліцин) — одна з них. Це кристалічна, білого кольору, добре розчинна у воді та солодка на смак речовина (мал. 38).
 Аміноетанова кислота (гліцин) і ліки на її основі
Аміноетанова кислота (гліцин) і ліки на її основі
БІЛКИ ЯК ВИСОКОМОЛЕКУЛЯРНІ СПОЛУКИ. За допомогою пептидної групи можуть сполучатися не дві, а багато молекул амінокислот у різній послідовності. Ця унікальна властивість амінокислот забезпечила існування в природі найскладніших і найважливіших біополімерів — білків. Як і в розглянутій у попередньому параграфі взаємодії двох молекул амінокислот, процес утворення білкових макромолекул супроводжується утворенням молекул води. Білки різноманітні за складом і властивостями. Так, білки шерсті, нігтів, рогів, пір'я, шовку — нерозчинні у воді волокна. Білки крові, лімфи та інші — колоїдні розчини. У живій природі налічується понад 1010 різних білків.
Порівняно з молекулами інших речовин молекули білків бувають таких розмірів, що їх можна побачити в електронний мікроскоп.
Білки — це природні полімери, мономерами яких є α-амінокислоти. Структурні ланки в білковій молекулі з'єднані пептидними групами в поліпептидний ланцюг.
Сполуки з умістом від 10 до 100 α-амінокислотних залишків прийнято називати пептидами, понад 100 — білками.
Є й інша причина різноманітності білків — чотирирівнева організація структури білкових молекул (мал. 39).

Структурна організація білків: а — первинна структура; б — вторинна структура; в — третинна структура; г — четвертинна структура
Первинна структура білкових молекул — це послідовність чергування залишків α-амінокислот у поліпептидному ланцюзі (мал. 39, а). Більшість білкових молекул складається з 300-500 амінокислотних залишків, хоча може бути й 1500.
Вторинна структура білкових молекул — це форма поліпептидного ланцюга, що може бути ниткоподібною, спіралеподібною (мал. 39, б) та іншої форми. Спіралеподібна форма підтримується завдяки утворенню водневих зв'язків між пептидними групами, розміщеними на різних витках спіралі.
Третинна структура білкових молекул — це їх просторова конфігурація (мал. 39, в), досягнута завдяки взаємодії різних функціональних груп, які не брали участі в утворенні первинної та підтримці вторинної структур.
Четвертинна структура білкових молекул — поєднання у просторі кількох макромолекул, що дістало назву глобула (мал. 39, г).
Ви вже знаєте, що в крохмалю й целюлози відносна молекулярна маса приблизна, тому що ступінь полімеризації їх молекул буває різним. Відносні молекулярні маси білків чітко визначені. Так, поліпептидний ланцюг молекули гемоглобіну складається зі 141 амінокислотного залишку та гему — небілкової складової частини, до якої входять атоми Феруму. Відносна молекулярна маса гемоглобіну дорослої людини дорівнює 64 900 і є сумою відносних атомних мас 3032 атомів Карбону, 4816 атомів Гідрогену, 780 атомів Нітрогену, 872 атомів Оксигену, 8 атомів Сульфуру та 4 атомів Феруму.
Особливість білків полягає в тому, що відносна молекулярна маса кожного білка незмінна, мономерами однієї молекули можуть бути до двадцяти різних α-амінокислот.
З'ясування будови білків — визначне досягнення хімічної науки. Думку про утворення білкових макромолекул з α-амінокислот одним з перших висловив наш співвітчизник академік Іван Якович Горбачевський.
ХІМІЧНІ ВЛАСТИВОСТІ БІЛКІВ. Найважливішою хімічною властивістю білків є гідроліз.
1. Гідроліз білків.
У клітинах організмів він відбувається за участю ферментів, більшість з яких — білкового походження. У лабораторних умовах гідроліз білків здійснюють нагріваючи їх із сильними кислотами або лугами. Продуктами гідролізу є суміш амінокислот.
Гідроліз білкових молекул призводить до повної втрати ними всіх структур.
2. Денатурація (зсідання) білків.
Таку назву дістала втрата білками природних властивостей під впливом температури, кислот, лугів. Пригадайте приготування яєчні, смаження м'яса чи риби. Це приклади денатурації білків. Під час денатурації первинна структура білкових макромолекул зберігається, а решта — руйнуються. Наслідки денатурації мають незворотний характер для їх вторинної, третинної та четвертинної структур.
Проведемо дослід з денатурації білків. Для цього візьмемо білок курячого яйця та виготовимо його колоїдний водний розчин. Наповнимо пробірку на третину цим розчином та проведемо нагрівання. Досить швидко у пробірці відбудуться зміни. Білок зсядеться (денатурує), і прозорий колоїдний розчин перетвориться на білувату суспензію (мал. 40).

Денатурація білка курячого яйця
Більшість білків, зокрема білки клітин організму людини, не витримують нагрівання до високих температур. Ось чому під час різних захворювань людини температура тіла, що перевищує 40°С, є небезпечною для життя.
3. Кольорові реакції білків.
Білки серед інших речовин можна виявити за допомогою якісних реакцій — біуретової та ксантопротеїнової. Ці реакції також називають кольоровими реакціями на білки, оскільки їх ознаками є зміна кольору.
Біуретова реакція — це якісна реакція на пептидну групу. У лужному середовищі розчин білка за доливання розчину купрум(ІІ) сульфату набуває синьо-фіолетового забарвлення (мал. 41).
 Результат біуретової реакції
Результат біуретової реакції
Ксантопротеїнова реакція — це реакція на білки, які у своєму складі містять залишки ароматичних амінокислот. Розчин білка в присутності концентрованої нітратної кислоти набуває жовтого забарвлення (мал. 42).

Результат ксантопротеїнової реакції
Фіолетове забарвлення колоїдного розчину білка в результаті дії лугу і купрум(ІІ) сульфату та жовте забарвлення внаслідок дії на білок концентрованої нітратної кислоти — кольорові реакції білків.
Виконайте досліди, описані в рубриці «Хімія — це життя: сторінка природодослідника», та опануйте вміннями проводити розглянуті кольорові реакції білків.
Опрацювати п.26-29
31.03.2021
Тема: Узагальнення знань з теми
«Оксигеновмісні органічні сполуки»
https://www.youtube.com/watch?v=5aVvZbOc61E
Завдання
з однією правильною відповіддю
1. Вкажіть загальну формулу одноатомних насичених спиртів:
а) CnH2n-1OH;
б) CnH2n+1OH;
в) CnH2nO;
г) CnH2nO2.
2. Вкажіть суфікс, за допомогою якого утворюється назва спирту:
а) -ол-;
б) -ен-;
в) -он-;
г) -аль-.
3. Вкажіть формулу етилового спирту:
а) CH3 - OH;
б) C2H5 - OH;
в) C2H5 - COOH;
г) C3H7 - OH.
4. Вкажіть речовину, за допомогою якої можна розпізнати гліцерол:
а) свіжовиготовлений купрум(ІІ) гідроксид;
б) амоніаковий розчин Ag2O;
в) натрій гідроксид;
г) ферум(ІІІ) хлорид.
5. Вкажіть правильне твердження:
Жири — це естери:
а) етанолу і вищих карбонових кислот;
б) гліцеролу й оцтової кислоти;
в) гліцеролу і вищих карбонових кислот;
г) етанолу й оцтової кислоти.
6. Вкажіть речовину, за допомогою якої можна визначити оцтову
кислоту:
а) калій гідроксид;
б) арґентум(І) оксид;
в) лакмус;
г) фенолфталеїн.
7. Вкажіть формулу глюкози:
а) C6H12O6;
б) C12H22О11;
в) (C6H10O5)n;
г) C2H5OH.
8. Вкажіть формулу крохмалю:
а) C6H12O6;
б) C12H22О11;
в) (C6H10O5)n;
г) C2H5OH.
Завдання з двома правильними відповідями
9. Вкажіть фізичні властивості метанолу:
а) рідина з характерним запахом;
б) рідина без запаху;
в) добре розчиняється у воді;
г) погано розчиняється у воді;
д) має температуру кипіння 100
10. Вкажіть формули гомологів етанолу:
а) CH3 - OH;
б) CH3- O - CH3;
в) C3H7 - OH;
г) C3H7 - COOH.
11. Вкажіть сполуки, за допомогою яких можна розпізнати
багатоатомні спирти:
а) купрум(ІІ) оксид;
б) купрум(ІІ) сульфат;
в) натрій;
г) натрій гідроксид.
12. Вкажіть формули вищих насичених карбонових кислот:
а) C17H35COOH;
б) CH3- COOH;
в) C17H33COOH;
г) C15H31COOH.
13. Вкажіть функціональні групи глюкози:
а) карбонільна;
б) гідроксогрупа;
в) аміногрупа;
г) нітрогрупа.
14. Вкажіть сполуки, які можна одержати взаємодією оцтової кислоти
та натрій гідроксиду:
a) вуглекислий газ;
б) натрій ацетат;
в) водень;
г) вода.
Повторити п.
13-25
13.01.2021;20.01.2021
Тема: Карбонові кислоти, їх класифікація та
властивості. Етанова кислота.
Карбонові кислоти, на відміну від альдегідів, дуже поширені в природі
органічні сполуки. Вони входять до складу рослинних і тваринних організмів.
Мурашина, лимонна, щавлева, янтарна, яблучна кислоти є у вільному стані,
водночас залишки їхніх молекул містять у своєму складі жири, естери й інші
сполуки. До таких кислот належать етанова (оцтова), бутанова (масляна),
гексадеканова (пальмітинова), октадеканова (стеаринова) та ін.
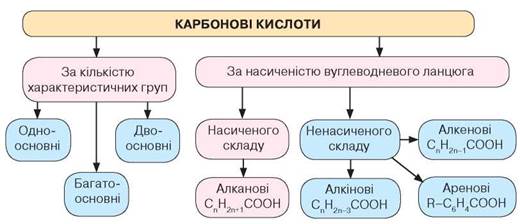
Класифікують
карбонові кислоти за кількістю в їхньому складі характеристичних
(функціональних) груп атомів -СООН. Якщо кислота містить у
своєму складі одну характеристичну (функціональну) групу, її називають
одноосновною, дві — двоосновною, більше — багатоосновною.
Залежно від природи
вуглеводневого ланцюга розрізняють гомологічні ряди кислот: насичені
одноосновні карбонові кислоти та ненасичені: алкенові, алкінові, ароматичні
(рис. 32).
Схема класифікації карбонових кислот
Склад і будова
молекул насичених одноосновних кислот. Ознайомившись зі схемою класифікації кислот,
можна зробити висновок: до насичених одноосновних карбонових кислот належать
такі, що у своєму складі містять одну характеристичну (функціональну)
карбоксильну групу -СООН і насичений вуглеводневий ланцюг. Їхню будову
розглядають як похідні алканів, у молекулах яких один атом Гідрогену заміщений
на карбоксильну групу
Насичені
одноосновні карбонові кислоти утворюють гомологічний ряд
Гомологічний ряд одноосновних карбонових кислот та
їхні фізичні властивості
|
Молекулярна формула |
Назва кислоти |
Температура, °С |
Агрегатний стан |
||
|
систематична |
тривіальна |
Тпл |
Т кіп |
||
|
Н-СООН |
Метанова |
Мурашина |
8 |
101 |
Рідини з різким запахом, добре розчинні у воді. |
|
СН3-СООН |
Етанова |
Оцтова |
17 |
118 |
|
|
С2Н5-СООН |
Пропанова |
Пропіонова |
-21 |
141 |
Оліїсті речовини, менш розчинні у воді, з неприємним
запахом. |
|
С3Н7-СООН |
Бутанова |
Масляна |
-7,9 |
164 |
|
|
С4Н9-СООН |
Пентанова |
Валеріанова |
-35 |
185 |
|
|
С5Н11-СООН |
Гексанова |
Капронова |
-3,4 |
205 |
|
.
Номенклатура
насичених одноосновних кислот. Утворення
назв гомологів за систематичною номенклатурою наведено в таблиці
Одноосновним
карбоновим кислотам властива структурна ізомерія карбонового ланцюга. Напишемо
структурні формули пентанової кислоти та її ізомерів:
Хімічні властивості етанової кислоти. На
хімічні властивості етанової кислоти впливає будова її характеристичної
(функціональної) групи.
Вам уже відомо, що
характеристична група молекули етанової кислоти складається з двох груп:
гідроксильної -ОН і карбонільної >С=О. Атом Оксигену, що міститься в складі карбонільної групи, відтягує на себе
електронну густину хімічного зв'язку, унаслідок чого зв'язок між атомами
Оксигену й Гідрогену в гідроксильній групі послаблюється. Зміщення електронної
густини, яке можна зобразити так:
визначає
кислотні властивості цієї речовини.
Для того щоб
переконатися, що різкої межі між неорганічними та органічними речовинами немає,
звернемося до таблиці і
порівняємо хімічні властивості насичених одноосновних карбонових кислот (на
прикладі етанової) і неорганічних (хлоридної, сульфатної) кислот.
Порівняльна характеристика хімічних властивостей
етанової та неорганічних кислот
Добування етанової кислоти. Вам
уже відомо, що внаслідок часткового окиснення альдегідів утворюються карбонові кислоти
Пригадайте
реакції часткового окиснення альдегідів. Напишіть рівняння реакцій.
Окиснення
етанолу. Етанову кислоту добувають окисненням етанолу за
наявності каталізатора. Рівняння реакції:
Окиснення етаналю. Оскільки
з реакцією часткового окиснення етаналю ви вже ознайомилися , то зазначимо, що
окисниками можуть бути й калій перманганат, калій дихромат та інші сильні
окисники. Рівняння реакції:
Економічно вигідний промисловий спосіб добування етанової кислоти — це
окиснення алканів повітрям за наявності каталізаторів.
Опрацювати п.18,19.
Немає коментарів:
Дописати коментар