07.05.2021
Тема: Значення води і водних розчинів у природі і житті людини
https://www.youtube.com/watch?v=eL1wiaZuo-s
Опрацювати п. 29 (підручник Г. А. Лашевська)
26.04.2021-
Тема: Поняття про індикатори.
• метилоранж,
• лакмус,
• фенолфталеїн.

https://www.youtube.com/watch?v=CdYOSUUra7o
https://www.youtube.com/watch?v=LrAo3_MPMbo
Опрацювати п.28. Виготовити природні індикатори із соку різних рослин. Випробувати їх на кислотах(оцтова) і розчинах миючих засобів. Результати записати в зошит. Фотоматеріали вислати за тел. 0967891535 у viber/
19.04.2021-
Тема: Взаємодія води з основами. Поняття про гідрати оксидів: кислоти, основи.
https://www.youtube.com/watch?v=E1Qmr7_PlsI
Вода реагує з оксидами деяких металічних елементів.
а) оксиди лужних металів : Літію, Натрію, Калію, Рубідію, Цезію (І група головна підгрупа).
Na2O + Н2О = 2NaOH
натрій оксид натрій гідроксид
б) оксиди лужноземельних металів: Кальцію, Стронцію,Барію (2 група головна підгрупа).
ВаО + Н2О = Ва(ОН)2
барій оксид барій гідроксид
в) з оксидами інших металів вода не реагує:
CuO + Н2О ≠ FeO + Н2О ≠
У результаті двох останніх реакцій, в яких реагентами є оксиди металічних елементів, утворюється речовини, що називаються основами.
Загальна назва сполук оксидів з водою – гідрати оксидів
.Основи — це складні речовини, утворені атомами металічних елементів і гідроксильними групами –ОН.
Гідроксильна група одновалентна. Me(OH)n - загальна формула основ.
Назва основи складається з назви металічного елемента та слова «гідроксид».
КОН - калій гідроксид
Fe(OН)3 - ферум(ІІІ) гідроксид
Cu(OН)2 - купрум (ІІ) гідроксид
Розчинні у воді основи називають лугами
NaOH, КОН, Ва(ОН)2, Са(ОН)2.
Більшість оксидів металічних елементів (FeO, Fe2O3, CrO, Cr2O3, CuO) не
реагують з водою, але їм теж відповідають основи (гідрати оксидів).
Таким чином:
Кислотний оксид + вода → кислота
Основни оксид + вода → основа
Більшість оксидів і відповідних їм гідратів є безбарвними сполуками, тому не завжди можна визначити їх наявність, або розрізнити кислоти і основи «на око». Для виявлення кислот і основ у розчинах використовують індикатори — складні сполуки, які змінюють своє забарвлення в залежності від наявності кислот або основ у розчинах.
Опрацювати п. 28 до ст.154 (підручник Г.А. Лашевська)
16.04.2021
Тема: Виготовлення розчину
Розглянемо, що необхідно робити, чим користуватися, щоб виготовити розчин з певною масовою часткою розчиненої речовини.
ЩО ПОТРІБНО ДЛЯ ВИГОТОВЛЕННЯ РОЗЧИНУ. Незалежно від того, які розчини виготовляють, використовують тільки чисті розчинники. Заздалегідь готують посуд і необхідне обладнання для приготування розчину, а також посуд для його зберігання. Ви напевне звернули увагу, що в хімічному кабінеті розчини зберігаються у скляних ємкостях, на яких обов’язково є етикетка із зазначенням вмісту розчиненої речовини.
У хімічних лабораторіях для приготування розчинів використовують посуд, виготовлений із матеріалів, які не вступають у реакцію з компонентами розчину. Найчастіше цим матеріалом є скло. Посуд для зберігання розчинів обов’язково повинен бути закритий спеціально підібраними кришками чи пробками, щоб у нього не потрапляли пил і повітря, з окремими компонентами яких розчин може прореагувати
Для виготовлення розчину з ценною масовою часткою розчиненої речовини потрібні: речовина для розчинення, розчинник, посудина для виготовлення розчину, скляна паличка чи ложечка для помішування, терези, різноважки, мірний посуд (мал. 106).
Виготовлення розчину з певною масовою часткою розчиненої речовини. Перед виготовленням розчину здійснюють обчислення маси розчинної речовини та об’єму розчинника.
Перш ніж виготовити розчин солі з певною масовою часткою розчиненої речовини, що перебуває в твердому агрегатному стані, необхідно:
1. Зважити розчинену речовину.
2. Перенести її у колбу (стакан).
3. Відміряти необхідний об’єм розчинника — води.
4. Добавити воду до розчиненої речовини.
5. Перемішати компоненти до утворення гомогенного розчину.
Опрацювати п. 27 (підручник Г.А. Лашевська)
29.03.2021-02.04.2021
Тема: Вода. Фізичні
властивості води. Вода як розчинник. Розчин і його компоненти.
Чиста вода не має смаку і запаху, за нормальної
температури (20 оС) знаходиться в рідкому вигляді.
"Вода" - це тривіальна назва, хімічну сполуку
називають оксидом водню. З назви можна зрозуміти, що в її складі містяться іони
водню і кисню, які пов'язані між собою так званим ковалентним зв'язком.
Атом водню має валентність (здатність утворювати зв'язки)
1, а атом кисню - 2. Завдяки цьому формула води саме H2O.
Також кожна молекула води здатна утворювати до чотирьох
водневих зв'язків (2 з них водень, 2 кисень). Всі аномалії фізичних
властивостей води пов'язані саме з ними — у води досить висока температура
кипіння (100°C). Якби не існувало водневих зв'язків, то вода кипіла б при
температурі -80°C, а замерзала б при -100°C. Така будова дозволяє нам бачити
воду в трьох агрегатних станах (лід, рідина, газ) в навколишньому природному
середовищі.
Вода є ідеальним розчинником, тому багато процесів
відбувається невидимо для нашого ока. Ось вони — якраз, і найцікавіші. У
природі не існує води, яка не містить домішок. У воді завжди розчинені
неорганічні солі, гази, а при антропогенному впливі ще і величезний асортимент
органічних речовин.
Наприклад, природна твердість
води обумовлена тим, що під час її
руху через породи, вона насичується мінералами. Залежно від складу порід, їх розчинності,
температури навколишнього середовища певні їх концентрації здатні розчинятися у
воді. Переважно такі породи представлені карбонатами, сульфатами, нітратами
кальцію, магнію, натрію, калію та ін. катіонів. Мабуть, основними мінералами,
які становлять базис жорсткості, є гіпс (CaSO4), доломіт (CaCO3 •
MgCO3), вапняки (CaCO3).
Що стосується розчиненого заліза і марганцю, то вони характерні переважно для
природних свердловинних вод, оскільки розчинні солі заліза зазвичай
"мешкають" в просторі з недостачею повітря. Джерелами їх є переважно
магнітний, бурий, червоний залізняки, магнезит та ін.
Сірководень також зберігається глибше ґрунтових вод, як
продукт хімічних процесів серед органічних речовин. На повітрі теж схильний
окиснюватися до елементарної сірки й випадати в осад (зазвичай невидимий
людському оку).
У природних поверхневих водах завжди
міститься розчинений кисень і азотовмісні компоненти, які виходять як наслідок
життєдіяльності мікроорганізмів — це амоній, нітрити, нітрати, які з легкістю
перетворюються один в одного. Також у водоймах завжди є білки й амінокислоти.
Що ж стосується антропогенного навантаження, то саме
завдяки йому в воду вносяться найтоксичніші забруднювачі: солі важких металів;
промислові органічні продукти; нітрати й фосфати застосовуються як добрива.У
воді постійно відбуваються якісь реакції. Це й обмінні процеси, які викликають,
наприклад, осадження накипу, що складається з карбонату кальцію. І
окислювально-відновні, через які у свердловинній воді з'являється рудувата
залізна муть або осад на стінках. Вода — це складна хімічна система, і кожен
елемент завжди має своє джерело.
https://www.youtube.com/watch?v=HDMpcz9_B6I
Опрацювати п. 25,26 (підручник Г.А. Лашевська)
11.01.2021;15.01.2021
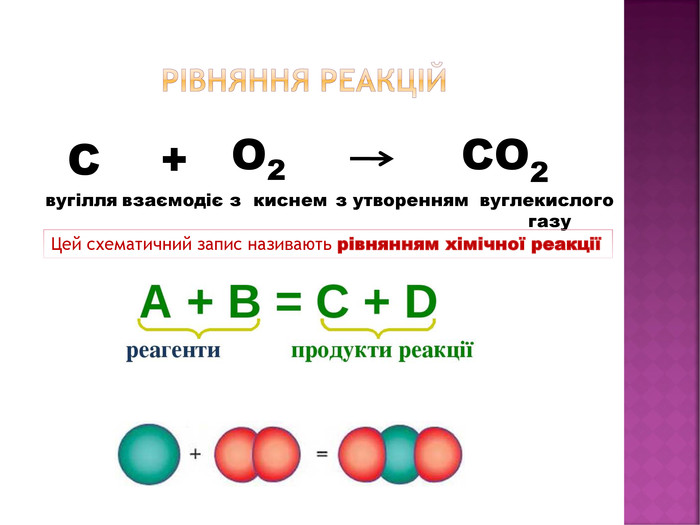
Тема: Схеми хімічних
реакцій. Хімічні рівняння
Опрацювати: п.19.
18.01.2021
22.01.2021
Тема: Добування кисню
в лабораторії і промисловості. Реакція розкладу. Поняття про каталізатори.
У промисловості кисень одержують
електролізом води та з повітря
а) електролітичний метод
Через воду пропускають електричний струм, під дією
якого вона розпадається на водень та кисень:
2H2O ел.
струм 2Н2 +О2 Для
того, щоб вода проводила електричний струм до неї додають інші речовини (луги
або сульфати лужних металі).
Установка
для виробництва кисню методом електролізу води
б)
розділення повітря.
Цей метод ґрунтується на використанні
різниці температури кипіння газів, з яких складається повітря. Спочатку
зріджують повітря. Для цього його сильно стискають (100-200 атм.), а після
цього різко знижують тиск. Внаслідок цього повітря сильно охолоджується й
переходить у рідкий стан (при температурі -192 °С). Рідке повітря переганяють у
ректифікаційній колоні. Оскільки азот кипить при -196 °С, а кисень - при -183
°С, із рідкого повітря спочатку відганяється азот, а потім кисень.
Установка
для одержання кисню із повітря (киснева станція)
Методи
збирання кисню
Розповідь учителя.
Існує два методи збирання кисню: метод
витіснення повітря та метод витіснення води.
а) метод витіснення повітря
Кисень важчий від повітря, отже
посудину-приймач слід тримати дном донизу. Кисень буде опускатися на дно
посудини витісняючи повітря, що міститься в ній.
б) метод витіснення води.
Посудину-приймач заповнюють водою по
вінця. Закривають та перевертають догори дном. Опустивши отвір посудини у
кристалізатор з водою, її відкривають під водою. Вода тримається у посудині.
Знизу через трубку надходить кисень, який піднімається вгору, виштовхуючи воду.
Виявлення
кисню Розповідь учителя. Кисень підтримує горіння. Тому тліюча скіпка спалахує,
щойно стикається з киснем.
Одержання
кисню в лабораторії
Розповідь учителя. У лабораторії кисень одержують у невеликих кількостях.
Для цього використовують речовини, які легко розкладаються з виділенням кисню
незалежно від того, зустрічаються вони в природі чи добуті штучно. Для
одержання кисню в лабораторії використовують термічно нестійкі оксиди, солі й
інші речовини.
Розклад калій перманганату.
Розповідь вчителя.
2KMnO4= K2 MnO 4 + MnO2 +O2 ↑
Розклад оксидів важких металів. Розповідь учителя. Оксиди
важких металів розкладаються під дією температури:
2Нg0 = 2Нg + O2 ↑
Розклад гідроген пероксиду. Розклад гідроген пероксиду відбувається швидше в
присутності манган(ІV)оксиду.
MnO2
2Н202 →2Н20 + 02↑
Опрацювати п.20.
Виконати домашній експеримент на ст.113(підручник Г.А.Лашевська)




Немає коментарів:
Дописати коментар