Хімія 7 клас
https://meet.google.com/kyf-hwgs-pzp - посилання на онлайн уроки (за розкладом)
Навчальні проекти з хімії
1.Хімічні явища в побуті.
2. Хімічні явища в природі.
3. Використання хімічних явищ у художній творчості і народних ремеслах.
4. Хімічні речовини навколо нас.
5. Історичне значення вогню.
6. Проблема чистоти водойм.
7. Забруднення повітря і його наслідки.
23.05.2023 - 26.05.2023
Тема: Узагальнення знань з теми "Вода", "Кисень"
Захист творчих проєктів.
https://www.youtube.com/watch?v=HHdWONB-fzU
Взаємодія води з оксидами металічних елементів. Ви вже ознайомилися з основною хімічною властивістю кисню — підтримувати горіння. Крім того, за участю кисню відбуваються реакції повільного окиснення. У результаті цих реакцій утворюються складні речовини — оксиди.
Пригадайте, чи тільки прості речовини, згоряючи, утворюють оксиди.
Звернемося до демонстраційних дослідів і з’ясуємо, як вода проявляє себе щодо оксидів. Уважно спостерігайте за перебігом реакцій.
Дослід 1. У порцелянову чашку насиплемо грудочки кальцій оксиду (негашене вапно). Обережно доллємо води.
Відбувається бурхлива взаємодія води з кальцій оксидом, що супроводжується виділенням великої кількості теплоти
Про що свідчить виділення теплоти?

. Взаємодія негашеного вапна з водою
Кальцій оксид унаслідок реакції перетворюється на пухкий білий порошок — гашене вапно (тривіальна назва). Відбулася реакція:

Дослід 2. Дослідження порошку кальцій оксиду на розчинність у воді показало, що він частково розчиняється з утворенням розчину, мильного на дотик. Добутий розчин розіллємо у дві пробірки. До розчину в першій пробірці доллємо розчин фенолфталеїну, до другої — лакмус фіолетовий. Спостереження показують, що забарвлення фенолфталеїну змінилося на малинове, а лакмусу — на синє.
Речовини, що змінюють своє забарвлення під дією лугів або кислот, називають індикаторами.
Ученими досліджено, що зміна забарвлення фенолфталеїну на малинове, а лакмусу — на синє відбувається в лужному середовищі. Отже, унаслідок реакції води з кальцій оксидом утворився гідрат оксиду (сполука оксиду з водою), що виявляє лужні (основні) властивості.
У хімії такі гідрати оксидів металічних елементів називають основами. Відповідно оксиди, які утворюють основи, називають основними.
Подібно до того, як взаємодіє з водою кальцій оксид, реагують натрій оксид, калій оксид та ін. Наприклад:
Na2O + Н2О = 2NaOH
Розчинні у воді основи називають лугами.
Більшість оксидів металічних елементів (FeO, Fe2О3, CrО, Cr2О3, CuО) не реагують з водою, але їм теж відповідають гідрати оксидів.
Взаємодія води з оксидами неметалічних елементів. З реакцією добування фосфор(V) оксиду ви вже ознайомилися під час виконання досліду горіння фосфору
Дослід 3 (дослід проводять під тягою). Для демонстрації взаємодії фосфор(V) оксиду з водою в хімічну склянку наливають воду, над якою в ложці для спалювання речовин спалюють червоний фосфор. Утворений фосфор(V) оксид взаємодіє з водою. Якщо в добутий розчин додати лакмус, його забарвлення змінюється на червоне. Зміна забарвлення лакмусу свідчить про появу кислого середовища. Отже, фосфор(V) оксид, сполучаючись із водою, утворює кислоту. Рівняння реакції:

Вода взаємодіє також з іншими оксидами неметалічних елементів: сульфур(VІ) оксидом, карбон(ІV) оксидом, нітроген(V) оксидом. Відповідно утворюються сульфатна H2SO4, карбонатна Н2СО3 і нітратна HNO3 кислоти. Наприклад:
СО2 + Н2О ⇄ Н2СО3
Отже, гідратами оксидів неметалічних елементів є кислоти. Оксиди, яким відповідають кислоти, називають кислотними.
Д.З. Повторити основні поняття хімії: знаки, молекулярна маса, валентність, хімічні рівняння.
16.05.2023 - 19.05.2023
Тема: 1.Узагальнення знань з теми "Вода"
2. Контрольна робота
Д.З. Повторити основні поняття хімії: знаки, молекулярна маса, валентність, хімічні рівняння. Повторити п.17-29.Виконати контрольну роботу. (матеріали к.р. будуть надіслані у Viber)
09.05.2023 - 12.05.2023
Тема: Розв'язок задач.
https://youtu.be/o_RLYT_qnSw
Розглянемо на прикладах задач, яким чином обчислюють масові часки елементів у сполуках.
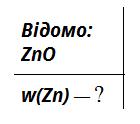
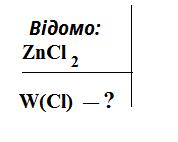
02.05.2023 - 05.05.2023
Тема: 1. Проблема чистої води.
2. Очищення води на водоочисних станціях і в домашніх умовах.
https://youtu.be/CYv7Li_UEJs - проблема чистої води
https://youtu.be/tEqbf4Gj5f0 - очищення води
Методи очищення води в домашніх умовах
Відстоювання
Це найпростіший метод Вам знадобиться закрита ємність, бажано використовувати скляну і керамічний посуд, Ні в якому разі не можна використовувати алюмінієву Можна поставити воду на ніч, а вранці обережно процідити її через кілька шарів марлі В ємність з водою можна покласти який-небудь срібний предмет ( ложечку, ювелірний виріб) Ідеально для такого очищення використовувати тару з срібла Тоді ефект буде максимально результативний Але застосовуючи цей метод, потрібно бути обережними, тому що в організмі може спостерігатися надлишок іонів срібла.
Кип'ятіння
Для очищення питної води від шкідливих домішок хлору, виробляють кип'ятіння При цьому, знищується велика частина бактерій Але не можна забувати, що хлор, при високих температурах, утворює шкідливі сполуки Труби, по яких вода надходить у квартири, бувають іржавими, і в результаті, ми отримуємо воду з надлишком заліза, яке в процесі кип'ятіння жевріє При кип'ятінні утворюється мертва або важка вода.
Замороження
Тут необхідне дотримання технології У невелику ємність набирається вода, потім ставиться в морозильну камеру Через 2 години на поверхні можна побачити крижану кірку - це шкідливі домішки Необхідно їх видалити, рідину переливають в чисту ємність і ставлять ще на 2-3 години в холодильник За це час все солі і домішки осідають на дно Така вода корисна людям з хворобою шлунково-кишкового тракту, хронічним панкреатитом.
Активоване вугілля
Для цього способу очищення застосовують різні види активованого вугілля Чим дрібніше насипаний вугілля і більше шар вугілля, тим якість очищення краще Якщо відсутній спеціальний активоване вугілля, то можна звернути кілька таблеток в марлю, кинути в посудину з водою і відстоювати воду в прохолодному місці протягом 12 годин Для того, щоб очистити воду від мікроорганізмів, рекомендується додати ще і спеціальні добавки, що містять іони срібла.
Система очищення води для будинку
Це найефективніший спосіб очищення питної води. Фільтр для будинку очищає воду від механічних частин домішок і хлору.
Існують три способи очищення:
- механічний;
- іонообмінний;
- зворотний осмос.
Стаціонарні фільтри встановлюються в квартирі в систему труб холодного водопостачання Надійний і простий настільний фільтр, який підключається до крана холодної води.
Природні камені
Вода, настояну на кварці, сприяє обміну речовин і позитивно позначається на кровообігу Кремній зміцнює імунну систему організму, позбавляє від болю в суглобах, зміцнює стінки кровоносних судин Перед настоюванням кварц потрібно промити Протягом 3 днів відбувається настоювання в співвідношенні: 200 г кварцу на 3 х літрову ємність Воду можна підливати, але сам кварц, необхідно, при цьому, промивати Щоб посилити дію очищення, кварц змішується з кремнієм В цьому випадку, якість цілющої води значно посилюється.
Д.З. Опрацювати матеріал підручника, сайту, відео.
Підготуйте розповідь. проєкт про воду.
25.04.2023 - 28.04.2023
Тема: 1. Значення води і водних розчинів у природі і житті людини.
2. Кислотні дощі. Охорона водойм. Проблема чистої води.
1. https://youtu.be/ycKEmFBraMw
2. https://youtu.be/Mv-MulKEjrE
1. Вода — джерело життя на Землі. Вона використовується як сировина у промисловості, джерело енергії, вона є чинником, що визначає погоду, клімат нашої планети.
Вода має позитивне й негативне значення у природі.
Негативне:
1. Руйнує планету, утворюючи яри, печери, пустелі.
2. Розчиняючи в собі величезну кількість речовин, стає непридатною для використання: 97 % — солоні води океанів, морів, 3 % — прісна вода.
3. Під час сильних штормів забирає тисячі людських життів, руйнує міста й села.
4. Разом із киснем повітря призводить до іржавіння заліза (руйнує корпуси кораблів, водопостачальні й каналізаційні труби, мости, гідроспоруди).
Позитивне:
1. Міститься в організмах тварин і рослин, що забезпечує біохімічні процеси: в організмі ссавців міститься 70 % води, людини — 65 %; огірків — 90%.
2. Ґрунтові води забезпечують ріст і живлення рослин.
3. Забезпечує мікроклімат на планеті.
4. Надихає художників, композиторів, письменників і поетів на створення нових творів.
5. Відіграє велике значення у практичній діяльності людини. Воду використовують у:
• промисловості;
• побуті;
• медицині;
• сільському господарстві;
• рослинництві;
• тваринництві
2. Природне забруднення — це стікання у водойми дощових (кислотних) і талих вод, наводнення, що спостерігаються від злив, які змивають береги річок, наносять мул із гір, полів, лугів. Це й рештки відмерлих тваринних і рослинних організмів.
Наслідком штучного забруднення є спускання відходів промислових підприємств і населених пунктів у природні водойми. Це спричинює зміни фізичних і хімічних властивостей води, зумовлює непридатність її використання як у побуті, так і в промислових масштабах.
Глобальною проблемою є забезпечення належної кількості та якості води. Нестача прісної води або низька її якість, невідповідність водних джерел нормативним вимогам спричинили зростання захворюваності людей, загибель риби, планктону. Тому з метою збереження та раціонального використання водних ресурсів необхідно охороняти їх від різних видів забруднень.
Охорона вод передбачена Водним кодексом України (22.05.2008 p.). Глава 20 цього кодексу має назву «Охорона вод від забруднення, засмічення і вичерпання».
Отже, під охороною вод розуміють цілий комплекс заходів, спрямованих на запобігання й усунення наслідків забруднення, засмічування та виснаження вод. Вони забезпечують розробку методів і засобів очищення води, контролю її якості.
У природі відбувається постійний колообіг води (рис. 81). Завдяки сонячній енергії вода із запасів Світового океану частково випаровується. Охолоджуючись, вона потрапляє знову у води Світового океану та на сушу. Води суші вбираються рослинами, використовуються тваринами й людиною. Продуктами життєдіяльності живих організмів є вуглекислий газ і вода. У річках водообмін відбувається за декілька днів, а в організмі людини — за декілька годин.
Під час колообігу вода переносить тепло, розчиняє природні сполуки, частково руйнує тверду оболонку планети. Вона забезпечує середовище існування водних організмів і рослин, які виробляють кисень і поповнюють ним атмосферу.
Природні водойми мають здатність до самоочищення. Однак ця здатність залежить від багатьох чинників: об’єму річного стоку, швидкості потоків, хімічного складу води, її температури тощо. Унаслідок розвитку різних галузей промисловості, транспорту, авіації, сільського господарства природні водойми вже не можуть самоочищатися, тому потрібні штучні споруди для очищення води.
Очищення води на водоочисних станціях. Вода, що використовується для приготування їжі й ниття, має бути позбавлена грубих нерозчинних домішок і мікробів, які можуть спричинити різноманітні захворювання або епідемії.
- Пригадайте, яким способом розділяють суміші, що містять нерозчинні речовини. Запропонуйте свою схему очищення води.
Очищення води від нерозчинних домішок здійснюють шляхом її відстоювання та фільтрування. Наступний етап очищення полягає в позбавленні води хвороботворних бактерій. З цією метою воду озонують, хлорують, обробляють ультрафіолетовим випромінюванням.
Для очищення води від розчинених у ній речовин використовують перегонку (дистиляцію). Цей процес здійснюють в електричних дистиляторах, перегінних кубах. Позбавити воду деяких домішок можна кип’ятінням, використанням речовин, які утворюють з наявними у воді домішками нерозчинні сполуки, що випадають в осад.
Вивчивши тему «Вода» та здійснивши екскурсію па водоочисну станцію, ви зможете оцінити, яку незрівнянну, порівняно з іншими речовинами, роль відіграє вода в житті людей, сформувати навички дбайливого поводження з водою, раціонального її використання.
Д.З. опрацювати матеріал підручника, сайту, відео.
18.04.2023 - 21.04.2023
Тема: 1. Поняття про гідрати оксидів, основи, кислоти. Індикатори
2. Самостійна робота (21.04.23)
https://youtu.be/Iv7m773LUU0 - гідрати оксидів
https://youtu.be/sZbmNo1Qkpo - індикатори
Індикатори — речовини, які змінюють колір залежно від середовища розчину.
Середовище може бути кислотним (кислим, наявність кислот), нейтральним (чиста вода) і лужним (розчин лугів).
В якості індикаторів найчастіше на практиці використовують:
• метилоранж,
• лакмус,
• фенолфталеїн.
Метилоранж у водному розчині (у нейтральному середовищі) має оранжеве забарвлення, лакмус — фіолетове.
У розчинах кислот і метилоранж, і лакмус набувають червоного кольору.
У розчинах основ (лугів) метилоранж набуває жовтого забарвлення.
Червоний і синій кольори при змішуванні дають фіолетовий. Лакмус у розчинах основ стає синім.
Обидва індикатори більш зручні на практиці для визначення кислого середовища.
Фенолфталеїн є індикатором на лужне середовище. Лише у ньому він набуває яскраво малинового забарвлення. В інших середовищах він є безбарвним.
Самостійна робота (21.04.23)
1. (0,5 бал.)Яка хімічна формула води?
А H2O2;
Б H2O ;
В O2H;
Г (OH)2
2. (0,5 бал.) Вода - це:
А проста речовина;
Б складна речовина;
В суміш;
І. У чистої води немає смаку й запаху.
ІІ. Густина льоду більша за густину води.
А лише І
Б лише ІІ
В обидва правильні
Г немає правильних
4. (1 бал.) Чи є поміж наведених тверджень правильні?
І. Температура кипіння води за тиску 1 атм дорівнює 100 °С.
ІІ. Температура замерзання води за тиску 1 атм дорівнює 4°С.
А лише І
Б лише ІІ
В обидва правильні
Г немає правильних
ІІ. Цукор добре розчиняється у воді.
А лише І
Б лише ІІ
В обидва правильні
Г немає правильних
6. (1 бал.) Чи є поміж наведених тверджень правильні?
І. Масова частка розчиненої речовини – відношення маси розчиненої речовини до маси розчинника.
ІІ. Маса розчину дорівнює сумі мас розчиненої речовини і розчинника .
А лише І
Б лише ІІ
В обидва правильні
Г немає правильних
7. (1,5 бал.) Яка масова частка (%) цукру в розчині, для виготовлення якого використали цукор масою 40 г і воду масою 160г?
8. (1,5бал.) Обчисліть масу солі та води, необхідні для приготування розчину масою 50 г із масовою часткою солі 5 %.
9. (3 бал.) До 250 г водного розчину цукру з масовою часткою розчиненої речовини 10 % додали350 г води. Обчислити масову частку цукру в розчині, який утворився.
Д.З. опрацювати матеріал підручника, сайту, відео. Виконати самостійну роботу.
11.04.2023 - 14.04.2023
Тема: Взаємодія води з оксидами. Поняття про гідрати оксидів, основи, кислоти.
https://youtu.be/E1Qmr7_PlsI - взаємодія води з оксидами, основи
https://youtu.be/jnwwpNlU5Cc - взаємодія кислотних оксидів з водою, індикатори
Кислотні оксиди – оксиди утворені неметалічним елементом, металом з валентністю вище IV.
Основні оксиди – оксиди утворені металічними елементами з валентностями І, ІІ, дуже рідко ІІІ.
Вода – найпоширеніший оксид.Вона є хімічно стійкою речовиною. ЇЇ молекули починають розкладатися лише за дуже високої температури ( за 2 500 їх розкладається майже 11% від загального числа, а за 1000 - лише 0,03%). Продуктами розкладу є водень і кисень: 2Н2О → 2Н2 + О2
Однією з найважливіших є реакція води з оксидами.
Відомо, що вуглекислий газ здатний розчинятися у воді. У такому стані він міститься в мінеральній воді. різних газованих напоях. Водночас з розчиненням відбувається хімічна реакція газу з водою з утворенням вугільної кислоти. яка надає розчину слабо кислого смаку. Відповідно хімічне рівняння має такий вигляд: СО2 + Н2О = Н2СО3
Так само вода реагує і з іншими оксидами неметалічних елементів. Продуктами цих речовин є різні кислоти. Такий самий процес взаємодії вуглекислого газу і деяких інших газів з водою в атмосфері призводить до так званих « кислотних дощів».
SO2 + H2O = H2SO3
P2O5 +3 H2O = 2H3PO4
Що є спільного між всіма кислотами?
Кислоти – це складні сполуки, що складаються з одного чи кількох атомів Гідрогену, зв’язаних з кислотним залишком
Hn КЗ
Майже всі реакції води з оксидами – це реакції сполучення. Не є винятком і реакція оксиду металічного елемента Кальцію CaO. Вона широко використовується на практиці ( гасіння вапна). До негашеного вапна (це – CaO, що має домішки) додають воду. Утворюється гашене вапно – кальцій гідрогид : СаО + Н2О = Са(ОН)2
Вода реагує з оксидами деяких металічних елементів.
а) оксиди лужних металів : Літію, Натрію, Калію, Рубідію, Цезію (І група головна підгрупа).
Na2O + Н2О = 2NaOH
натрій оксид натрій гідроксид
б) оксиди лужноземельних металів: Кальцію, Стронцію,Барію (2 група головна підгрупа).
ВаО + Н2О = Ва(ОН)2
барій оксид барій гідроксид
в) з оксидами інших металів вода не реагує:
CuO + Н2О ≠ FeO + Н2О ≠
У результаті двох останніх реакцій, в яких реагентами є оксиди металічних елементів, утворюється речовини, що називаються основами.
Загальна назва сполук оксидів з водою – гідрати оксидів
.Основи — це складні речовини, утворені атомами металічних елементів і гідроксильними групами –ОН.
Гідроксильна група одновалентна. Me(OH)n - загальна формула основ.
Назва основи складається з назви металічного елемента та слова «гідроксид».
КОН - калій гідроксид
Fe(OН)3 - ферум(ІІІ) гідроксид
Cu(OН)2 - купрум (ІІ) гідроксид
Розчинні у воді основи називають лугами
NaOH, КОН, Ва(ОН)2, Са(ОН)2.
Більшість оксидів металічних елементів (FeO, Fe2O3, CrO, Cr2O3, CuO) не
реагують з водою, але їм теж відповідають основи (гідрати оксидів).
Таким чином:
Кислотний оксид + вода → кислота
Основни оксид + вода → основа
Більшість оксидів і відповідних їм гідратів є безбарвними сполуками, тому не завжди можна визначити їх наявність, або розрізнити кислоти і основи «на око». Для виявлення кислот і основ у розчинах використовують індикатори — складні сполуки, які змінюють своє забарвлення в залежності від наявності кислот або основ у розчинах.
Індикатори — речовини, які змінюють колір залежно від середовища розчину.
Середовище може бути кислотним (кислим, наявність кислот), нейтральним (чиста вода) і лужним (розчин лугів).
В якості індикаторів найчастіше на практиці використовують:
• метилоранж,
• лакмус,
• фенолфталеїн.
Метилоранж у водному розчині (у нейтральному середовищі) має оранжеве забарвлення, лакмус — фіолетове.
У розчинах кислот і метилоранж, і лакмус набувають червоного кольору.
У розчинах основ (лугів) метилоранж набуває жовтого забарвлення.
Червоний і синій кольори при змішуванні дають фіолетовий. Лакмус у розчинах основ стає синім.
Обидва індикатори більш зручні на практиці для визначення кислого середовища.
Фенолфталеїн є індикатором на лужне середовище. Лише у ньому він набуває яскраво малинового забарвлення. В інших середовищах він є безбарвним.
Д.З. опрацювати матеріал підручника, сайту, відео
Домашня лабораторія: перегляньте відео https://youtu.be/NDKkLbTK7zQ, виготовте індикатори із природних матеріалів. Для їх виготовлення можна взяти червонокачанну капусту, сік моркви, сік вишні, сік малини, сік чорної смородини (бажано щоб сік був не солодкий, якщо використовуєте варення то розбавте кип'яченою водою). Проробіть досліди, як на відео. Запишіть результати.
04..04.2023 - 07.04.2023
Тема: Кількісний склад розчину. Розв'язок задач.
Виготовлення розчину.
https://youtu.be/Lypy40Sz3Z0 - розв'язок задач
https://youtu.be/cWZoXp_bhuY - виготовлення розчину
https://youtu.be/7lrBK94JjjI - виготовлення розчину
Д.З. опрацювати матеріал підручника, сайту, відео. Дати відповіді на запитання останнього відео.
21.03.2023 - 24.03.2023
Тема: Кількісний склад розчину. Масова частка розчиненої речовини.
https://youtu.be/r0xxl4xyFvQ - масова частка розчиненої речовини
https://youtu.be/Lypy40Sz3Z0 - розв'язок задач
14.03.2023 - 17.03.2023
Тема: Фізичні властивості води. Вода-розчинник.
Розчин і його компоненти: розчинник, розчинна речовина.
https://youtu.be/sGkTLgX3H9s - фізичні властивості води
https://youtu.be/VB6d8Q7Mpew - розчин
https://youtu.be/UkeWq0fdpF4 - розчин і його компоненти
07.03.2023 - 10.03.2023
Тема: Захист навчальних проектів.
Вода. Склад молекули. Поширення в природі.
https://youtu.be/rypc-eu4dYg
Вода (гідроген оксид)
H2O — найпоширеніша речовина на Землі. Це єдина речовина, яка існує на планеті одночасно в трьох агрегатних станах. Рідка вода покриває 75 % земної поверхні річками, озерами, морями і океанами. Велика кількість твердої води у вигляді льоду зосереджена на Північному і Південному полюсах. Газоподібна вода міститься в атмосфері.
Вода у природі
Вода входить до складу всіх живих організмів. Наприклад, організм людини містить 50−80 % води (в залежності від віку), риби — 80 %. У живій клітині вода є середовищем, у якому протікають життєво важливі процеси. Вона бере участь у багатьох біохімічних реакціях (фотосинтез, гідроліз складних органічних речовин). Жоден організм не може обходитися без води. Так, велике дерево для забезпечення всіх життєвих потреб влітку поглинає з грунту і випаровує протягом доби 500–700 дм³ води, а людина без води не може прожити більше 4 днів.
Живим організмам потрібно прісна вода. Її запаси на планеті обмежені. Тому важливого значення набуває проблема охорони водних джерел від забруднення і економного витрачання прісної води.
У природі абсолютно чистої води не буває. У ній завжди містяться домішки. Для
одержання особливо чистої води використовують дистиляцію (перегонку). Воду випаровують, а потім пари конденсують у приймачі.
Отримана таким способом вода називається дистильованою і застосовується для
приготування ліків, лабораторних розчинів, тощо.
Будова води
Вода — складна речовина, утворена атомами двох елементів — Оксигену і Гідрогену. Формула молекули води — H2O. Структурна формули води:
H - ОН
Молекула води має кутову будову. Кут між зв'язками становить 104,5°.
Домашня робота
1. Повторити матеріал
з теми "Кисень". Використати матеріали підручника та матеріали сайту.
2. Виконати навчальний
проект (теми запропоновані вище).
3. Вивчити матеріал підручника
28.02.2023 - 03.03.2023
Тема: Узагальнення знань з теми "Кисень" Захист навчальних проектів.
1. Повторити матеріал з теми "Кисень". Використати матеріали підручника та матеріали сайту.
2. Виконати навчальний проект (теми запропоновані вище).
21.02.2023 - 24.02.2023
Тема: Колообіг Оксигену в природі. Озон. Проблема чистого повітря, роль кисню. Розв'язок задач.
https://youtu.be/tDfnHgHmmXE - відносна молекулярна маса
https://youtu.be/xu5lq-sCpvc - масова частка елемента
https://youtu.be/TVYaGoJEg3o - хімічні реакції
Д.З. перегляньте відео. Повторіть основні поняття хімії, правила виконання розрахунків. Повторити п. 21
14.02.2023 - 17.02.2023
Тема: Колообіг Оксигену в природі. Озон. Проблема чистого повітря, роль кисню.
https://youtu.be/QyGdp17O7Ac - кисень, озон
https://youtu.be/FU69f8pal94 - колообіг Оксигену
Домашнє завдання: опрацювати матеріал підручника, конспект, відео. Скласти оповідання, казку "Подорож молекули КИСНЮ"
07.02.2023 - 10.02.2023
Тема: Взаємодія кисню з складними речовинами
Тема: Умови виникнення і припинення горіння. Маркування небезпечних речовин.
Умови виникнення та припинення горіння цікавили людину із часів її першого знайомства з вогнем. Що саме потрібно для виникнення горіння? Насамперед - речовини, між якими відбуватиметься реакція, тобто горюча речовина та кисень. Вони мають тісно контактувати між собою, однак цього часто замало. Дрова у грубці не загоряються самі, хоча навколо них - повітря, яке містить кисень. Їх потрібно запалити, тобто довести температуру деревини до такої, щоб почалася її взаємодія з киснем. Для цього не потрібен безпосередній контакт дерева з вогнем
Температура займання різних речовин неоднакова. Гас загоряється за 400 °С, сірка - за 450 °С, деревний пил -за 610 °С, білий фосфор - за 45-60 °С (залежно від ступеня його здрібнення).
Для продовження горіння, що почалося, подальше нагрівання вже не потрібне. Речовина нагрівається за рахунок тепла, яке виділяється внаслідок горіння. Під час горіння палива виділяється прихована в ньому хімічна енергія - теплова та світлова.
Щоб почалося горіння скіпки, потрібно ввести її кінчик у полум’я пальника. У цьому місці деревина нагрівається до потрібної температури і загоряється. Найближча до вогню ділянка скіпки нагрівається від тепла, що виділяється внаслідок горіння. Процес поширюється все далі й далі, захоплюючи нові й нові ділянки скіпки.
Інколи горюча речовина сильно здрібнена. Тобто є тонким порошком (вугільний, цукровий, борошняний пил) або дрібними розпорошеними в повітрі краплями (аерозоль гасу, бензину). Унаслідок підпалювання таких сумішей речовин з повітрям тепло швидко поширюється на всі боки. Уся суміш миттєво нагрівається до температури займання. Відбудеться швидке згоряння - спалах
Отже, для виникнення горіння потрібний тісний контакт горючої речовини з повітрям і нагрівання до температури займання. Якщо хоча б однієї із цих умов не буде дотримано, горіння не виникне. Зрозуміло, що для запобігання виникненню горіння досить порушити хоча б одну із зазначених умов.
Щоб припинити горіння палива в топках печей або послабити горіння, скорочують приплив кисню, закриваючи піддувало.
На умови припинення горіння зважають під час гасіння пожеж (рис. 22.3). Якщо горить дерев’яний будинок, намагаються баграми видалити з вогню горючі матеріали. Вогонь засипають піском, накривають цупкою тканиною, заливають водою, піною. Вода, потрапляючи на палаючу речовину, знижує її температуру, водяна пара, що утворюється, перешкоджає доступу повітря.

Наше життя неможливе без процесів горіння. Тож кожен має знати умови виникнення та припинення горіння, прийоми безпечного поводження з горючими та вогненебезпечними речовинами.
Марковання небезпечних речовин - важливий чинник захисту споживача, його здоров’я, довкілля тощо. Безпечне використання речовин передбачає їхнє розпізнавання, розуміння небезпеки, яку вони становлять для здоров’я людини і навколишнього середовища, розроблення засобів контролю їхнього вмісту в споживчих товарах. Ці відомості мають бути оформлені так, щоб головна інформація про ризики та застережні заходи була виділена й надана споживачеві у доступній формі. Важливим аспектом реалізації конституційного права громадян на інформацію є зрозуміле та чітке марковання товару (рис. 22.4).

Рис. 22.4. Марковання небезпечних речовин. 1. Вибухонебезпечна речовина. 2. Пожежонебезпечна речовина, окисник. 3. Пожежонебезпечна речовина, легкозаймиста. 4. Отруйна речовина. 5. Шкідлива для здоров’я подразнювальна речовина. 6. Їдка речовина. 7. Небезпечна для довкілля речовина
Марковання — це інструмент, який допомагає споживачеві зробити свідомий вибір.
Цікаво і пізнавально
Запровадження «Глобально збалансованої системи класифікації маркування хімікатів» - Globally Harmonized System of Classification and Libelling of Chemicals (GHS) - має на меті забезпечення інформацією про фізичну небезпеку та токсичність хімікатів для поліпшення захисту здоров’я людини та довкілля під час поводження з ними, їхнього транспортування та використання.
Розглянемо докладніше, як маркують засоби побутової хімії і речовини у їхньому складі. Етикетка має містити назву товару, відомості про його склад, інструкцію щодо безпечного використання, застережний знак і його словесну інтерпретацію (поміркуйте, чому на засобах для миття посуду немає застережних знаків), відомості про виробника (поясніть, для чого). Свідомий споживач повинен узяти до уваги інформацію на етикетці та неухильно виконувати інструкцію з безпечного використання товару, щоб мінімізувати ризики, пов’язані із цим.
ПРО ГОЛОВНЕ
Для виникнення горіння потрібний тісний контакт горючої речовини з повітрям (киснем у його складі) і нагрівання до температури займання. Для продовження горіння потрібне подальше нагрівання горючої речовини.
Для припинення горіння треба видалити горючу речовину, охолодити її нижче від температури займання, перекрити доступ кисню.
Кожна людина має знати умови виникнення й припинення горіння, прийоми безпечного поводження з горючими та вогненебезпечними речовинами.
Уміння читати марковання небезпечних речовин й правильно його розуміти потрібне кожній людині.
https://www.youtube.com/watch?v=_wHHDm_JhaM
Тема: Взаємодія кисню з складними речовинами
Реакції повільного окиснення та горіння простих і складних речовин мають велике практичне значення для людини. За їх участю добувають оксиди, що можуть бути як сировиною для промисловості, так і виконувати функції каталізаторів у виробничих процесах. З цими реакціями пов’язаний процес дихання. Людський організм використовує глюкозу та інші органічні речовини як джерело енергії, яка вивільняється від їх окиснення. Під час повільного окиснення (гниття решток рослин) виділяється теплота, яку використовують у теплицях для вирощування овочів.
Електричну енергію, що забезпечує населення світлом, добувають перетворенням теплової енергії. У побуті реакцію горіння використовують для приготування їжі, а горіння сухого пального, дров — у туристичних походах
Реакції кисню зі складними речовинами. Кисень може взаємодіяти не лише з простими, а й зі складними речовинами. Такі реакції відбуваються, наприклад, коли горять етиловий спирт, ацетон, природний газ, який складається переважно з метану (мал.).

Мал. Горіння природного газу
Молекула метану CH4 містить атоми Карбону і Гідрогену, а молекула етилового спирту С2Н5ОН — ще й атом Оксигену. Внаслідок взаємодії цих речовин із киснем утворюються оксиди Карбону і Гідрогену — вуглекислий газ і вода (в газуватому стані):
CH4 + 2O2 =t CO2 + 2H2O;
С2Н5ОН + 3О2 =t 2СО2 + 3Н2О.
Ці оксиди виділяються також унаслідок спалювання деревини, нафтопродуктів, багатьох інших органічних речовин.
Гідроген сульфід, або сірководень, — газ, що має формулу H2S. За наявності кисню чи надлишку повітря він горить з утворенням сірчистого газу і водяної пари:
H2S + O2 →t SO2 + H2O.
• Перетворіть схему реакції на хімічне рівняння.
Кисень взаємодіє з деякими оксидами. Продуктами таких реакцій є інші оксиди, в яких елементи виявляють вищі значення валентності, ніж у вихідних сполуках. Наприклад, чадний газ, згоряючи в повітрі, перетворюється на вуглекислий газ:
2CO + O2 =t 2CO2.
Горіння. Розглянуті реакції супроводжуються однаковими зовнішніми ефектами.
Хімічну реакцію, під час якої виділяється теплота і з'являється полум'я, називають горінням.
https://www.youtube.com/watch?v=s__fQ0WZI68
Домашнє завдання: опрацювати матеріал підручника, конспект, відео
31.01.2023 - 03.02.2023
24.01.2023 - 27.01.2023


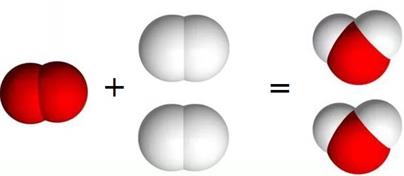
Д.З. Опрацювати матеріали сайту, відео, підручник п. 21 №18 ст. 121
17.01.2023 - 20.01.2023
Тема:
Мета:
Обладнання;
Хід роботи
1. Виконати практичну роботу на основі матеріалів підручника або відео
https://youtu.be/OMVVYjg5DD0
2.Описати досліди, дані спостережень оформити у вигляді таблиціі
| № з/п | Що робили? | Що спостерігали? |
| 1 | ||
| 2 | ||
| 3 | ||
| 4 |
Висновок:
10.01.2023 - 13.01.2023
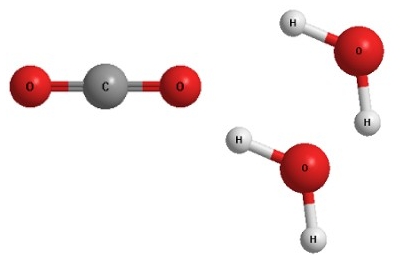
Схема хімічної реакції. З попереднього параграфа ви дізналися, що суть перетворень, які відбуваються під час хімічних реакцій, можна описати на мікрорівні за допомогою графічних схем (рис. 18.1.1). Ту саму інформацію можна записати за допомогою хімічних формул і математичних знаків. Та сутність хімічного перетворення не залежить від того, якою мовою його описують. Щоб переконатися в цьому, проаналізуємо три описи реакції синтезу води.
Графічна схема цього перетворення зображена на рисунку 18.1.1. Її словесний опис такий: молекула кисню (простої речовини) складається з двох атомів Оксигену. У двох молекулах водню (також простої речовини) - чотири атоми Гідрогену. Молекула кисню і дві молекули водню перетворюються на дві молекули води (складної речовини), у кожній з яких - атом Оксигену і два атоми Гідрогену. Опис за допомогою хімічних формул: О2 + 2Н2 → 2Н2О. Саме він є найкомпактнішим. Замість стрілки в ньому потрібно поставити знак «дорівнює» - адже число атомів кожного з елементів у лівій і правій частинах запису однакове.
Запис 2Н2 + О2 = 2Н2О - хімічне рівняння реакції синтезу води.
Хімічне рівняння - умовний запис хімічної реакції за допомогою хімічних формул і математичних знаків. Коефіцієнти в хімічному рівнянні показують найпростіші співвідношення між числом структурних частинок реагентів і продуктів реакції.
Хімічні рівняння ви складатимете в певній послідовності. Розглянемо її на прикладі синтезу води з простих речовин.

Продовження таблиці

- Перетворіть схеми реакцій на хімічні рівняння:
![]()
б) Fe + Cl2 → FeCl3;
в) К + Н2O → КОН + H2↑;
![]()
д) Al(OH)3 → Al2O3 + H2O;
e) HNO3 → H2O + NO2 + O2;
ж) Fe(OH)2 + H2O + O2 → Fe(OH)3;
з) Mg + HCl → MgCl2 + H2;
і) KBr + Cl2 → KCl + Br2;
к) Zn + O2 → ZnO.
2. https://youtu.be/xFS8xOU5K4c - добування кисню
Д.З. Опрацювати матеріали сайту, відео, підручник.
20.12.2022 - 23.12.2022
На основі робіт М. В. Ломоносова і А. Лавуазьє було сформульовано закон збереження маси.
Хімічне рівняння — це умовний запис хімічної реакції за допомогою хімічних формул, знаків «
Д.З. Опрацювати матеріали сайту, відео, підручник.
13.12.2022 - 16.12.2022
https://youtu.be/8jqBxAeizW8
https://youtu.be/1e3N6tmMR78
Повітря, його склад. Перші спроби вивчення та визначення складу повітря належать А. Лавуазьє.

Лавуазьє Антуан Лоран (1743-1794) — французький хімік, один з основоположників сучасної хімії. Пояснив, що процеси горіння й окиснення речовин, дихання живих організмів відбуваються за участю кисню, що спростувало існуючу на той час теорію флогістону. Учений був першим, хто встановив хімічний склад води, сульфур(ІV) і карбон(ІV) оксидів, сульфатної та нітратної кислот. Керував розробкою нової хімічної номенклатури й склав перший систематизований перелік назв. Під час хімічних досліджень А. Лавуазьє застосовував методи кількісного аналізу. Його вважають одним із засновників термохімії. Праці вченого сприяли перетворенню хімії на науку, що спирається на факти й точні вимірювання.
Учений провів низку дослідів, які довели наявність у повітрі кисню та азоту. Найбільш відомий з них такий. Учений поклав у реторту металічну ртуть і нагрівав її впродовж 12 днів (рис. 57). Кінець реторти дослідник помістив під дзвін, що був уміщений у посудину зі ртуттю. За тривалого нагрівання в реторті на поверхні ртуті утворилася речовина у вигляді порошку червоного кольору. Водночас під дзвоном рівень ртуті піднявся.

Рис. 57. Прилад, яким користувався А. Лавуазьє, вивчаючи склад повітря: 1 — реторта; 2 — дзвін; 3 — посудина зі ртуттю
Отриманий порошок А. Лавуазьє прожарив. Унаслідок реакції він отримав ртуть і газ кисень. Важливим було те, що об’єм газу відповідав об’єму частини повітря, що сполучилася зі ртуттю.
Учений дослідив, що залишається в повітрі, якщо забрати кисень. Він помістив під дзвін запалену свічку, і вона погасла. У повітрі під ковпаком гинули миші. Зважаючи на ці факти, А. Лавуазьє назвав газ, що залишився під ковпаком, азотом, тобто «тим, що не підтримує життя».
Уміст кисню в повітрі вчений довів експериментально. Цей дослід неважко повторити. Під час спалювання фосфору в повітрі під дзвоном рівень води піднімається приблизно на 1/5 об’єму дзвону. Так А. Лавуазьє довів, що в повітрі кисень становить 1/5 й азот — 4/5 частин за об’ємом.
Майже через століття виявилося, що в повітрі наявна ціла група газів, які є одноатомними, не мають кольору й запаху та хімічно інертні. До них належать: гелій Не, неон Ne, аргон Ar, криптон Kr, ксенон Хе, радон Rn. Їх називають благородними газами.
Унаслідок детального вивчення складу повітря були отримані більш точні результати. Об’ємні частки газів у повітрі становлять: азот — 78,08 %, кисень — 20,95 %, благородні гази — 0,94 %, карбон(ІV) оксид — 0,03 % (рис. 58).
Охорона повітря від забруднення. Як вам уже відомо, кисень підтримує життя на Землі. Цей газ необхідний не тільки людині, а й тваринам і рослинам. Тому для підтримання життя на Землі людство має зберігати чистоту повітря.

Рис. 58. Діаграма складу повітря за об’ємом
Забруднення повітря відбувається як природним шляхом, так і внаслідок господарської діяльності людини.
До природних чинників належать: виверження вулканів і поширення вулканічного пилу в повітрі, урагани й бурі, що розносять пил, пори й пилок рослин тощо.
Чинниками, що спричиняють забруднення повітря внаслідок господарської діяльності людини, є спалювання побутового сміття, сухого листя, трави восени тощо. У повітрі нагромаджуються домішки газів, що потрапляють до нього завдяки викидам заводів, фабрик, роботі вутле-, нафто- й метало- добувних підприємств тощо. Зокрема, це сульфур(ІV) оксид SO2, карбон(ІІ) оксид СО, нітроген(ІV) оксид ΝΟ2, метан СН4, амоніак ΝΗ3. Випробовування атомної зброї та недбале поводження з мирним атомом часто стає причиною забруднення повітря радіоактивними речовинами (рис. 59).
Збереження чистоти повітря — справа всієї міжнародної спільноти й України в тому числі.
Оксиген — хімічний елемент. Назва Оксиген означає «той, що породжує кислоти». Цей елемент є найпоширенішим у природі.
Пригадайте й назвіть основні оболонки планети Земля.
Оксиген міститься в літосфері (47 % за масою), атмосфері (21 % за масою) і гідросфері (89 % за масою). Цей хімічний елемент входить до складу води, гірських порід і мінералів, багатьох неорганічних та органічних речовин.
Пригадайте й запишіть хімічний символ Оксигену. Знайдіть цей елемент у періодичній системі. Охарактеризуйте Оксиген за даними клітинки періодичної системи.
Кисень. Фізичні властивості кисню. Кисень є простою речовиною хімічного елемента Оксигену.
Пригадайте, що вам відомо про кисень з вашого життєвого досвіду, з інших шкільних предметів.
Ще у VIII ст. китайський учений Мао Хоа виявив у складі повітря кисень — газ, що підтримує дихання й горіння. Через 10 століть цей газ був знову відкритий двома європейськими вченими — К. Шеєле (1771 р.) і Дж. Прістлі (1774 р.). Однак в історії відкриття кисню належить Дж. Прістлі, бо К. Шеєле опублікував своє відкриття на три роки пізніше (1777 р.).
Молекула кисню складається з двох атомів. Хімічна формула кисню — О2. За нормальних умов (температура 0 °С, тиск 101,3 кПа) кисень перебуває в газоподібному стані, не має смаку, запаху, трохи важчий за повітря. Маса повітря об’ємом 1 л (н. у.) становить 1,29 г, а маса такого самого об’єму кисню — 1,43 г.
Обчисліть відносну молекулярну масу кисню. У скільки разів кисень важчий за повітря?
Кисень є малорозчинним у воді: в 1 л можна розчинити тільки 0,04 г кисню. За температури -183 °С кисень перетворюється на рухливу рідину блакитного кольору. За подальшого охолодження (до -219 °С) він стає твердою речовиною синього кольору, дуже подібною до кристалів льоду.
Фізіологічна дія кисню на живі організми. Кисень бере активну участь у процесах дихання всіх живих організмів.
Для людини дихання — життєво важливий процес. Через легені кисень потрапляє в кров, яка розносить його до всіх органів і клітин організму. На клітинному рівні відбуваються реакції окиснення з виділенням теплоти й вуглекислого газу. Отже, кисень, який міститься в чистому повітрі, потрапляючи в кров, забезпечує життєдіяльність людського організму: допомагає підтримувати постійну температуру тіла, роботу м’язів, а відтак і гарний настрій, і здоровий життєвий тонус.
У цьому для кожного з вас полягає цінність знань про повітря, Оксиген, кисень.
ПІДСУМОВУЄМО ВИВЧЕНЕ
- Повітря — природна суміш газів, до складу якої входять за об’ємом: азот (78,08 %), кисень (20,95 %), благородні гази (0,94 %), карбон(ІV) оксид (0,03 %).
- Оксиген — хімічний елемент, порядковий номер якого — 8, символ — О, відносна атомна маса — 16. У ядрі атома Оксигену міститься 8 протонів і 8 нейтронів. Навколо ядра атома рухаються 8 електронів.
- Кисень — проста газоподібна речовина, утворена елементом Оксигеном. Хімічна формула — О2, відносна молекулярна маса — 32. Малорозчинний у воді, за певних умов перетворюється на рідину блакитного кольору, а остання — на кристали синього кольору, подібні до льоду. Не має запаху й смаку.
- Кисень є життєво важливою для живих організмів речовиною. За його участю відбувається процес дихання, обмін речовин
- Д.З. Опрацювати матеріали сайту, відео, підручник.
06.12.2022 - 09.12.2022
Захист навчальних проектів.
1. Виконайте письмово завдання, надіслані в учнівську групу Viber 2. Виконати навчальний проект (на вибір)
29.11.2022 - 02.12.2022
- Хімічні властивості речовин – це їх здатність до певних хімічних перетворень.
- Будь-який хімічний експеримент починається із спостереження.
Виконати практичну роботу №3
Тема:
Мета:
Обладнання;
Хід роботи
1. Виконати практичну роботу на основі матеріалів підручника або відео
https://youtu.be/MmOvkBK4GJg
2.Описати досліди, дані спостережень оформити у вигляді таблиціі
| № з/п | Що робили? | Що спостерігали? |
| 1 | ||
| 2 | ||
| 3 | ||
| 4 |
Висновок:
Кожна складна речовина утворена кількома елементами. Відомості про кількісний вміст елементів у сполуці часто є важливими для її практичного використання. Наприклад, кращим азотним добривом вважають таке, в якому атомів Нітрогену міститься більше за масою, ніж в інших добривах (цей елемент потрібний рослинам). Так само оцінюють якість залізної руди, визначаючи, наскільки вона «багата» на елемент Ферум.
Кількісний вміст хімічного елемента у сполуці характеризують його масовою часткою. Цю величину позначають латинською літерою w (дубль-ве)1.
1 Схожою за написанням є грецька літера ω (омега).
Виведемо формулу для обчислення масової частки елемента у сполуці за відомими масами сполуки та атомів (або йонів) елемента в ній. Позначимо елемент літерою Е, а невідому масову частку цього елемента — літерою х. Врахувавши, що маса сполуки — ціле, а маса елемента m(Е) — частина від цілого, складаємо пропорцію:

Масова частка елемента у сполуці — це відношення маси елемента до відповідної маси сполуки.
Зауважимо, що маси елемента і сполуки потрібно брати в однакових одиницях вимірювання (наприклад, у грамах).
Масова частка не має розмірності. Її часто виражають у відсотках. У цьому разі формула має такий вигляд:
![]()
Очевидним є те, що сума масових часток усіх елементів у сполуці становить 1 (або 100 %).
Розглянемо приклади розв'язування задач, які передбачають обчислення або використання масових часток елементів у сполуках.
Умову розрахункової задачі та її розв'язання зазвичай подають у такий спосіб. Аркуш зошита чи класну дошку ділять вертикальною лінією на дві неоднакові частини. У лівій, меншій, частині скорочено записують умову задачі, потім проводять горизонтальну лінію, а під нею зазначають те, що потрібно знайти чи обчислити. У правій частині записують етапи розв'язання, пояснення, математичні формули, розрахунки і відповідь.
ЗАДАЧА 1. У 80 г сполуки міститься 32 г Оксигену. Обчислити масову частку Оксигену в сполуці.

ЗАДАЧА 2. Обчислити масові частки елементів у метані CH4.


За відомою масовою часткою елемента можна знайти масу елемента, яка міститься в певній масі сполуки. Із математичної формули для масової частки елемента випливає:
m(E) = w(E) · m(сполуки).
ЗАДАЧА 3. Яка маса Нітрогену міститься в аміачній селітрі1 масою 1 кг, якщо масова частка цього елемента у сполуці становить 0,35?
1 Азотне добриво.

ВИСНОВКИ
Масова частка елемента у сполуці — це відношення маси елемента до відповідної маси сполуки. Масову частку елемента також обчислюють за хімічною формулою сполуки.
За масовою часткою елемента можна розрахувати його масу, яка міститься в певній масі сполуки.
1. Як обчислити масову частку елемента у сполуці, якщо відомі:
- а) маса елемента і відповідна маса сполуки;
- б) хімічна формула сполуки?
2. Якою є масова частка елемента в простій речовині?
3. У 20 г речовини міститься 16 г Брому. Знайдіть масову частку цього елемента в речовині, виразивши її звичайним дробом, десятковим дробом й у відсотках.
4. Обчисліть (бажано усно) масові частки елементів у сполуках, що мають такі формули: SO2, SiH4, CrO3.
В оточуючому нас світі нічого немає постійного, весь час відбуваються певні зміни: день змінює ніч, одна пора року змінює іншу, серед літнього сонячного дня набігає хмаринка і йде рясний дощ, у світі відбуваються війни, одна політична система змінює іншу, … Світ мінливий.
Зміни, які відбуваються навколо нас, називаються явищами. Явища можуть бути суспільні, природніми, фізичними, хімічними.
Хімія вивчає речовини. Кожна речовина має певну сукупність ознак, за якими вона відрізняється від інших речовин.
Ознаки, за якими речовини відрізняються від інших речовин або подібні їм, називаються властивостями.
| Властивість | Цукор | Оцтова кислота |
| Агрегатний стан за н.у. | твердий | рідкий |
| Запах | відсутній | різкий |
| Колір | білий | безбарвна |
| Смак | солодкий | кислий |
| Температура плавлення | ||
| Густина |
Перераховані в таблиці властивості відносяться до фізичних властивостей. Також до фізичних властивостей відносяться: розчинність у воді, електро- та тепловідність, притягування магнітом, ковкість, пластичність. Вода при температурі 0ºС переходить у твердий стан – лід, але після того, як лід розтане, ми отримаємо воду, яка буде мати такі ж властивості, що і до переходу у твердий стан, тобто вода нових властивостей не набула. Такі явища відносяться до фізичних.
Явища, під час яких речовина не змінює своїх властивостей, а змінює тільки форму, або агрегатний стан, називаються фізичними.
 При проведенні електричного струму через воду в приладі, зображеному на малюнку. Рівень води у трубках зменшується. Піднесемо тліючу скибку до трубки: де більший об'єм води – спалахне, а де менший – газ почне горіти блакитним полум'ям. Ми бачимо, що в результаті пропускання електричного струму через воду утворились дві нові газоподібні речовини: кисень, який підтримує горіння, та водень,який горить блакитним полум'ям.
При проведенні електричного струму через воду в приладі, зображеному на малюнку. Рівень води у трубках зменшується. Піднесемо тліючу скибку до трубки: де більший об'єм води – спалахне, а де менший – газ почне горіти блакитним полум'ям. Ми бачимо, що в результаті пропускання електричного струму через воду утворились дві нові газоподібні речовини: кисень, який підтримує горіння, та водень,який горить блакитним полум'ям.
Явища, під час яких утворюються нові речовини з новими властивостями, називаються хімічними.
Хімічні властивості – це сукупність хімічних реакцій, які притаманні даній речовині. Наприклад, взаємодія оцету з питною содою, горіння деревини.
Хімічні явища називаються хімічними реакціями. Хімічні реакції супроводжуються певними ознаками:
- Утворення осаду.
- Виділення газу.
- Зміна забарвлення.
- Виділення тепла і світла.
Для того, щоб відбулася хімічна реакція, необхідні певні умови:
- Контакт реагуючих речовин.
- Певний температурний режим.
Д.З. Опрацювати матеріали сайту, відео, підручник
ЯК ВИЗНАЧИТИ ВАЛЕНТНІСТЬ ЕЛЕМЕНТА ЗА ФОРМУЛОЮ БІНАРНОЇ СПОЛУКИ? Одержати відповідь на поставлене запитання допоможе вам інформація з таблиці
Таблиця
Визначення валентності елемента за формулою бінарної сполуки
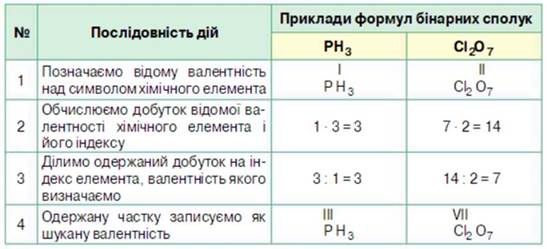
• Щоб визначити валентність елемента за формулою бінарної сполуки, необхідно добуток величини валентності й індексу одного елемента поділити на індекс іншого.
Як бачимо, визначення валентності елемента в бінарній сполуці є оберненою дією до складання формул бінарних сполук, розглянутих у попередньому параграфі.
ЗВ’ЯЗОК МІЖ РОЗМІЩЕННЯМ ЕЛЕМЕНТА У ПЕРІОДИЧНІЙ СИСТЕМІ ТА ЙОГО ВАЛЕНТНІСТЮ. Зверніть увагу, що валентність набуває значення від І до VIII і груп у періодичній системі також вісім. Навіть позначені вони, як і валентність, римськими цифрами. Значення постійної валентності у більшості елементів збігається з номерами груп, у яких вони розміщені. Пересвідчимось у цьому, скориставшись періодичною системою і наведеним у параграфі 17 переліком елементів з постійною валентністю. Одновалентні Гідроген, Натрій, Калій розміщені у першій групі періодичної системи, двовалентні Магній, Кальцій, Барій, Цинк — у другій групі, тривалентні Алюміній і Бор — у третій.
Для елементів зі змінною валентністю на її максимальне значення вказує номер групи періодичної системи хімічних елементів Д. І. Менделєєва, у якій розташовано елемент. Це тому, що розміщення елементів зі змінною валентністю у групах за невеликим винятком пов’язане з можливим максимальним значенням їх валентності. Є винятки, в тому числі максимальне значення валентності Нітрогену — чотири, Купруму — два, Оксигену — постійно два, Флуору — постійно один. Знайдіть, у яких групах періодичної системи вони розташовані.
У попередньому параграфі розглядались формули P2O5, SO3, Cl2O7. Знайдіть, у яких групах періодичної системи розміщені елементи Фосфор, Сульфур, Хлор, та переконайтеся, що цс були формули з валентністю зазначених хімічних елементів, яка дорівнює номеру групи.
• Максимальна валентність багатьох атомів хімічних елементів збігається з номером групи, в якій вони розміщені.
Яка найвища валентність у Силіцію та Йоду? Поясніть свою відповідь.
Неметалічні хімічні елементи (за винятком VIII групи) утворюють леткі бінарні сполуки з Гідрогеном. Щоб визначити валентність елемента у такій сполуці, достатньо від 8 відняти номер групи, у якій неметалічний елемент розташований у періодичній системі.
Наприклад, щоб визначити валентність Сульфуру у сполуці з Гідрогеном, за періодичною системою з’ясовуємо, що Сульфур — елемент VI групи. Виконуємо віднімання: 8 - 6 = 2. Отже, Сульфур у бінарній сполуці з Гідрогеном — двовалентний. Сполучаючись із двома атомами одновалентного Гідрогену, він утворює речовину, відому під назвою сірководень H2S або гідроген сульфід. Це отруйна речовина, її легко виявити за запахом. Для сірководню характерніш запах тухлих яєць, а якщо точніше, то при псуванні яєць утворюється сірководень, запах якого відчувається на відстані.
Скарбничка ерудита
Досить часто в нижній частині періодичної системи є горизонтальний рядок із назвою «Вищі оксиди». У ньому для кожної групи написано загальні формули оксидів — таку назву мають бінарні сполуки елементів з Оксигеном. Літера Е означає елемент. Валентність елементів у бінарних сполуках з Оксигеном здебільшого збігається з номером групи. На прикладі формул, розглянутих у тексті параграфа, перевірте, наскільки це відповідає дійсності та які існують винятки.
Рядком нижче містяться загальні формули летких водневих сполук тобто газоподібних бінарних сполук неметалічних елементів із Гідрогеном. Їх загальні формули з’являються з IV групи, й валентність елементів у них послідовно зменшується від IV до І. Дослідіть на прикладі неметалічних елементів 3-го періоду ці зміни, запишіть формули сполук.
ДОСЛІДЖУЄМО НА УРОЦІ ТА ВДОМА
Визначте валентність елементів у наведених формулах бінарних сполук: SeO2, NO2, Н2S, ВСl3, AsH3, SiH4, BF3.
Склад найменшої структурної частинки речовини (молекули чи формульної одиниці) можна виразити за допомогою хімічної формули. Оскільки ця частинка складається із певних хімічних елементів, то вона має масу, яка дорівнює сумі мас цих елементів з урахуванням кількості кожного із елементів, які входять до складу цієї частинки. Подібно до маси атома масу молекули або формульної одиниці порівнюють з 1/12 маси атома ізотопу 12С. Вона є важливою характеристикою речовини і називається відносною молекулярною масою Mr (молекулярна « relatives » - відносна).
Відносною молекулярною масою речовини називають відношення маси молекули даної речовини до маси атома Карбону-12.
, де
- маси молекули даної речовини;
– маса атома ізотопу
.
Відносну молекулярну масу легко вирахувати за хімічною формулою речовини.
Наприклад, розрахуємо відносну молекулярну масу речовини:
Mr(H2O) = 2 • Ar(H) + Ar(O) = 2•1 + 16 = 18
Приклад : Відносна молекулярна маса алюміній сульфату дорівнює:
Mr(AL2(SO4 )3) = 2 •Ar( AL ) + 3As(S) + 12 •Ar(O) = 2 • 27 + 3 • 32 + 12 • 16 = 342
Таким чином, за хімічною формулою можна визначити не тільки якісний і кількісний склад молекули або формульної одиниці речовини, а і її відносну молекулярну масу.
Перевірте свої знання
Визначте відносну молекулярну масу речовини, хімічна формула якої

ЩО НАЗИВАЮТЬ ВАЛЕНТНІСТЮ? Вчених здавна цікавило: чому молекули, що складаються з двох і більше атомів, становлять єдине ціле? Чим визначаються кількісні відношення атомів у молекулі? Відповідь на поставлені запитання була запропонована англійським хіміком Е. Франклендом, який увів у науку поняття валентності, що в перекладі з латини означає «сила».
• Валентність — це здатність атома приєднувати або заміщувати певну кількість інших атомів.
Деякі атоми мають постійну валентність, у більшості елементів є кілька значень валентності, тобто вона змінна.
Валентність виражається цілими числами. За одиницю валентності взято валентність Гідрогену, цей елемент одновалентний. Валентність може набувати значень від І до VIII.
Проаналізуємо хімічні формули:
![]()
Із першої формули бачимо, що у молекулі гідроген хлориду один атом одновалентного Гідрогену сполучений з одним атомом Хлору, тож Хлор у цій сполуці одновалентний. Друга формула свідчить, що з одним атомом Оксигену у молекулі води сполучені два атоми Гідрогену. Відповідно, розмірковуючи, робимо висновок, що Оксиген — двовалентний. За третьою формулою встановлюємо, що Нітроген в амоніаку — тривалентний, а за четвертою — що Карбон у метані має валентність ІV.
Запишемо розглянуті формули, позначивши валентність хімічних елементів над їх символами:
![]()
У розглянутих прикладах сума одиниць валентності Гідрогену дорівнює валентності іншого елемента. Наприклад, у формулі СH4 сума валентностей Гідрогену 1 • 4 = 4. Це правило поширюється на більшість бінарних сполук («бі» означає два), тобто утворених двома хімічними елементами.
• У бінарній сполуці сума одиниць валентності одного хімічного елемента дорівнює сумі одиниць валентності іншого елемента.
Розглянемо валентність деяких хімічних елементів та навчимося користуватися нею для складання формул бінарних сполук.
ЕЛЕМЕНТИ З ПОСТІЙНОЮ ТА ЗМІННОЮ ВАЛЕНТНІСТЮ. Елементів із постійною валентністю не так уже й багато. Їх приклади наведено в переліку:
![]()
Спробуйте його запам’ятати — це прискорить виконання вами багатьох вправ, пов’язаних зі складанням формул, визначенням валентності елемента в речовині за відомою валентністю інших елементів.
Атоми інших хімічних елементів (їх більшість) мають змінну валентність. Наприклад, у Сульфуру валентність набуває значень II, IV, VI; у Купруму — I, II; у Феруму — II, III; у Хлору — I, III, V, VІІ. Тому у назвах їх сполук після назви символу обов’язково вказують римськими цифрами у круглих дужках значення валентності, наприклад, Сульфур(VI) оксид має формулу SO3 (мал. 64, а), яку читають «ес-о-три». Інша бінарна сполука Сульфуру з Оксигеном SO2 (мал. 64, б) вимовляється «ес-о-два» і має назву сульфур(IV) оксид.

Мал. 64. Моделі молекул сполук Сульфуру з Оксигеном
Зверніть увагу, що в розглянутих прикладах змінна валентність елемента пишеться у круглих дужках і без відступу від його назви.
• У назвах складних речовин, утворених елементом зі змінною валентністю, після його символу без відступу записують валентність римською цифрою у круглих дужках.
СКЛАДАННЯ ФОРМУЛ БІНАРНИХ СПОЛУК ЗА ВАЛЕНТНІСТЮ. Складання формул бінарних сполук можна здійснювати у два способи. Послідовність дій у першому способі відображено у таблиці 6.
Таблиця 6
Складання формул бінарних сполук за валентністю

Використання другого способу складання формул (назвемо його діагональним) базується на тому, що у багатьох бінарних сполуках індекс одного елемента збігається з валентністю другого.
Переконайтеся в цьому на прикладах щойно складених формул P2O5 та SO3. Після послідовного виконання зазначених у таблиці перших двох дій маємо запис:
![]()
Далі, враховуючи зазначені валентності, записуємо індекс 2 для Фосфору (P2) і 5 для Оксигену (О5). Одержуємо формулу:
![]()
Аналогічно складаючи формулу сульфyp(VI) оксиду, ми мали б написати S2O6. Однак у формулах бінарних неорганічних речовин за невеликим винятком, прикладом якого є гідроген пероксид Н2О2 (у медицині його розчин називається «перекис водню»), індекси не бувають парними числами. Тому індекси 2 і 6 скорочуємо вдвоє й одержуємо хімічну формулу сульфур(VІ) оксиду — SO3.
• Діагональним способом зручно складати формули за валентністю, необхідно лише у разі парних індексів провести їх скорочення.
Потренуємось у використанні діагонального способу складання формул бінарних сполук. Формула сполуки Хлору з Оксигеном містить 5 атомів Оксигену. В атомів Оксигену постійна валентність II, в атомів Хлору — змінна.
Скориставшись діагональним способом, знаходимо індекс Хлору. Він дорівнює валентності Оксигену, тобто 2. Отже, формула сполуки: Сl2О5, Хлор у ній п’ятивалентний.
Поняття валентності поширюється й на хімічні елементи, з яких утворені прості речовини, що мають двохатомні молекули:
![]()
Скарбничка ерудита
Поняття валентності було введено в хімію у 1853 році, тобто майже на півсторіччя раніше, ніж фізикам удалося з’ясувати склад і будову атома Відкриття фізиків допомогли розвинути вчення про валентність за рахунок таких понять, як хімічний зв’язок та ступінь окиснення. Їх ви будете вивчати у 8-9 класах.

Нині наукою доведено, що атом — теж складне утворення. До його складу входять ще дрібніші частинки: протони, нейтрони й електрони.
Протони та нейтрони утворюють ядро атома.
Протони мають позитивний заряд +1 і масу 1,673 • 10-24 г. Для зручності оперування такими числами вчені використовують так звані відносні маси. Зокрема, відносна маса протона дорівнює 1. На письмі протони позначають так: 11р, де верхній індекс показує відносну масу, а нижній — заряд.
Нейтрони — незаряджені частинки (електронейтральні) з майже такою самою масою (1,675 • 10-24 г), як і протони, їх позначають 10п.
Навколо ядра атома рухаються електрони, що характеризуються найменшим негативним зарядом -1 і дуже малою масою, яка майже у 2000 разів менша, ніж маси протона й нейтрона.
Протони, що містяться в ядрі атома, надають йому позитивного заряду, тому й заряд атомного ядра визначають за загальним числом протонів.

Рис. 37. Модель будови атома Нітрогену
Кількість електронів, що рухаються навколо ядра атома, завжди така сама, як і кількість протонів. Завдяки цьому атом є електронейтральною (незарядженою) частинкою.
Атом — найдрібніша електронейтральна частинка речовини, яка складається з позитивно зарядженого ядра та негативно заряджених електронів, що рухаються навколо нього.
У ядрі атома зосереджується вся його маса, що чисельно дорівнює сумі протонів і нейтронів. Приклад будови атома Нітрогену показано на рис. 37.
Існує обмежена кількість атомів, відкритих і вивчених хімічною наукою. Вони утворюють 118 хімічних елементів, об’єднаних у таблицю, — Періодичну систему хімічних елементів Д. Менделєєва. Більшість із них (92 елементи) виявлені в природі, інші — добуті штучно під час ядерних реакцій.
Хімічні елементи. Поняття «елемент» означає «складова частинка речовини». На початку XIX ст. існування атомів підтвердив учений Дж. Дальтон. Йому ж належить термін «хімічний елемент».
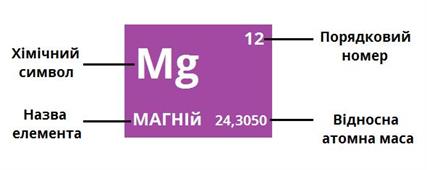
Хімічні елементи мають назви, що склалися історично та зумовлені їх походженням і властивостями. Сучасні назви хімічних елементів походять від їх латинських назв. Граматично вони є власними назвами, тому й пишуться з великої букви, наприклад: Гідроген, Оксиген, Карбон, Купрум, Ферум. Для зручності користування ними на письмі відомий учений Є. Берцеліус запропонував символи хімічних елементів, що складаються з перших літер їх латинських назв (однієї або двох). Наприклад: Оксиген — О, Ферум — Fe.
Назви, символи, відносна атомна маса хімічних елементів
Назва хімічного елемента | ХІМІЧНИЙ символ | Вимова символу | Відносна атомна маса |
Алюміній | АІ | алюміній | 27 |
Аргентум | Ag | аргентум | 108 |
Аурум | Au | аурум | 128 |
Барій | Ba | барій | 137 |
Бор | В | бор | 11 |
Бром | Br | бром | 80 |
Гідроген | Н | аш | 1 |
Іод | І | йод | 127 |
Калій | К | калій | 39 |
Кальцій | Са | кальцій | 40 |
Карбон | С | це | 12 |
Купрум | Cu | купрум | 64 |
Магній | Mg | магній | 24 |
Манган | Mn | манган | 54 |
Меркурій | Hg | гідраргірум | 201 |
Натрій | Na | натрій | 23 |
Нітроген | N | ен | 14 |
Оксиген | O | о | 16 |
Плюмбум | Pb | плюмбум | 207 |
Силіцій | Si | силіцій | 14 |
Сульфур | S | ес | 32 |
Станум | Sn | станум | 118 |
Ферум | Fe | ферум | 56 |
Флуор | F | флуор | 19 |
Фосфор | P | пе | 31 |
Хлор | Cl | хлор | 35,5 |
Цинк | Zn | цинк | 65 |
Як бачимо з таблиці , не всі елементи мають однакові назву й вимову символу. Тому для читання назв хімічних елементів необхідно вивчити й знати вимову хімічних символів.
Чисті речовини й суміші. Вам уже відомо, що кожна речовина складається з елементарних частинок — атомів і молекул. Чиста речовина містить частинки однакового складу, які відрізняються від частинок іншої речовини. Від того, які саме частинки входять до складу речовини, залежать її властивості. Розрізняють чисті речовини та суміші речовин.
Чисті речовини — це речовини, що складаються з частинок певного виду та мають сталі фізичні властивості.
Абсолютно чисті речовини в природі не трапляються. Учені їх добувають різними способами та вивчають їх властивості для використання в технічних і виробничих умовах.
Як уже зазначалося, у природі здебільшого трапляються суміші речовин. Наприклад, гірські породи, нафта, руди, вугілля, повітря, ґрунт, молоко. До складу сумішей можуть входити рідини, гази й тверді речовини.
При утворенні сумішей відбувається змішування речовин у довільних кількостях. Характерною особливістю сумішей є те, що в них кожна речовина зберігає свої індивідуальні властивості. Тому властивості сумішей визначаються сукупністю властивостей їх складових.
Суміш — це сукупність двох або більше речовин, які, змішуючись, зберігають свої властивості, а за необхідності піддаються розділенню.
За розміром частинок суміші поділяють на однорідні й неоднорідні (рис. 30).

Рис. 30. Класифікація сумішей
Однорідними сумішами є повітря, мінеральна вода, бензин, розчини цукру, солі, оцтової кислоти у воді, купрум(ІІ) сульфату у воді тощо (рис. 31). У них не можна виявити складових частинок речовин навіть за допомогою збільшувальних приладів.
Неоднорідними сумішами є молоко, яке розділяється під час відстоювання (рис. 32)·, граніт, у якому можна неозброєним оком виявити кварц, польовий шпат, слюду; суміш крейди з водою тощо. Для них характерно те, що частинки речовин, які утворюють цю суміш, є досить великими та проявляють різні фізичні властивості.

Рис. 31. Розчин κупрум(ІІ) сульфату у воді (однорідна суміш)

Рис. 32. Молоко (неоднорідна суміш)
Суміші, у яких частинки дуже дрібні, що їх не можна виявити за допомогою мікроскопа, називають однорідними.
Суміші, у яких частинки речовини можна побачити неозброєним оком або за допомогою мікроскопа, називають неоднорідними.
Способи розділення сумішей. Розділити суміші на окремі речовини можна фізичними методами. Розглянемо способи розділення сумішей детальніше. Їх застосування буде залежати від того, які речовини входять до складу суміші.
Відстоювання. Таким способом розділяють неоднорідні суміші твердих речовин, що не розчиняються у воді, або рідин, що відрізняються густиною. Наприклад, суміш залізних ошурків із порошком сірки можна розділити за допомогою відстоювання, доливши води до суміші, що міститься в скляному циліндрі (рис. 33).

Рис. 33. Розділення неоднорідної суміші залізних ошурків із порошком сірки способом відстоювання
Поясніть самостійно, які властивості речовин використано для розділення зазначеної суміші способом відстоювання.
Для розділення сумішей рідин, що характеризуються різними густинами, використовують ділильну лійку. Суміш рідин, наприклад, олії та води, наливають у ділильну лійку. Після відстоювання суміш розділяється на два шари: знизу збирається рідина з більшою густиною, а зверху — із меншою. Відкривають кран, і рідина, що зібралася знизу, стікає. У лійці залишається та, що має меншу густину.
Дія магніту. Варто пам’ятати про те, що існують суміші, для розділення яких можна скористатися кількома способами. Зокрема, суміш залізних ошурків із порошком сірки можна також розділити, застосовуючи дію магніту (рис. 34).
Поясніть самостійно, які властивості речовин використано для розділення вказаної неоднорідної суміші в цьому випадку.

Рис. 34. Розділення неоднорідної суміші залізних ошурків із порошком сірки дією магніту
Фільтрування. Цей спосіб використовують для розділення неоднорідних сумішей розчинних і нерозчинних у воді речовин, наприклад, суміші крохмалю з глюкозою або кухонної солі з піском. Якщо до такої суміші долити води, то одна речовина розчиниться, а інша — ні. Під час фільтрування розчинна речовина просочується крізь фільтр, а нерозчинна осідає на його поверхні (рис. 35 а). Розчин, що збирається в склянці, називають фільтратом.
У якості фільтру можуть використовуватися фільтрувальний (промокальний) папір, вата, щільна тканина, шар піску чи ґрунту. На водоочисних станціях, де очищають великі об’єми води, найчастіше використовують товстий шар чистого піску.

Рис. 35. Способи розділення сумішей: а — фільтрування; б — випарювання
Випарювання. Кристалізація. З фільтрату, отриманого в процесі фільтрування, можна виділити розчинену речовину способом випарювання. Для цього фільтрат поміщають у порцелянову чашку й нагрівають до кипіння (рис. 35 б). Під час кипіння вода випаровується, а розчинена речовина залишається на дні чашки. За неповного випарювання води утворюється концентрований розчин, який, охолоджуючись, кристалізується.
Отже, для повного розділення суміші крохмалю з глюкозою або кухонної солі з піском необхідно використати послідовно два способи розділення сумішей: відстоювання, за якого розділяють неоднорідні суміші, та випарювання з подальшою кристалізацією, завдяки чому можна розділити однорідні суміші.
Дистиляція. Цим способом розділяють рідини, що розчинені одна в одній, наприклад, розчин спирту у воді. Спосіб ґрунтується на використанні різних температур їх кипіння. Суміш наливають у колбу та нагрівають до температури кипіння (рис. 36). Спирт переходить у пару за температури 78 °С, що можна визначити за допомогою вставленого в колбу термометра. Пара надходить у внутрішню трубку холодильника, конденсується в ній та збирається в склянці-приймачі. Дистиляцію ще називають перегонкою. Цей спосіб має велике промислове значення.
Визначте за довідником температуру кипіння оцтової кислоти й поясніть, чи можна виділити її в чистому вигляді.

Рис. 36. Прилад для дистиляції: 1 — колба; 2 — термометр; 3 — відведення нагрітої води; 4 — внутрішня трубка холодильника; 5 — холодильник; 6 — подавання холодної води; 7 — склянка-збірник
У курсі природознавства ви вже ознайомилися зі способом очищення забрудненої кухонної солі, а працюючи з текстом параграфа, дізналися про різні способи розділення однорідних і неоднорідних сумішей, що ґрунтуються на знаннях про різні фізичні властивості їх компонентів. Важливо також набути практичних навичок розділення сумішей.
Тема: Практична робота №2 «Розділення неоднорідної суміші»
Мета:
- розділити суміш дерев’яних ошурок, піску і кухонної солі;
- навчитись працювати з лабораторним посудом, нагрівальними приладами;
Обладнання: суміш дерев’яних ошурок, піску і кухонної солі, свічка, хімічний стакан, скляна паличка, спиртівка, пробіркотримач, сірники, вода, шпатель, конусна колба, лійка, фільтрувальний папір, порцелянова чашка.
Хід роботи
| № з/п | Що робили? | Що спостерігали? |
| 1 | ||
| 2 | ||
| 3 | ||
| 4 |
3. Інструктаж з безпеки життєдіяльності:
- Робота із скляним посудом;
- Робота із спиртівкою.
4. Виконання роботи під керівництвом вчителя за інструкцією підручника.
- Висипати суміш у стакан з водою.
- Тирсу зібрати.
- Профільтрувати каламутний розчин.
- Випарити профільтрований розчин.
5. Оформлення роботи, формулювання узагальнюючого висновку.
| Що робили? | Що спостерігали? | Висновки | |
| 1 | Суміш дерев’яних ошурок, піску і кухонної солі висипали у хімічний стакан, залили водою. Тирсу зібрали шпателем. | Тирса сплила на поверхню, пісок осів на дно, сіль розчинилася. | Компоненти суміші мають різну розчинність у воді та густину. Цей спосіб розділення неоднорідних сумішей називають декантацією. |
| 2 | Виготовили фільтр. Каламутний розчин пропустили через фільтр. | Частинки піску осіли на стінках фільтрувального паперу. | Неоднорідну суміш розділили фільтруванням. |
| 3 | Фільтрат перелили у порцелянову чашку, нагріли у полум’ї спиртівки | Вода випарувалась, на стінках чашки утворились кристалики солі. | Однорідну суміш розділили випарюванням. |
Висновок:
Д.З. Опрацювати відеоматеріали, матеріали підручника п. 6-7 (підручник Г.А. Лашевська)
https://www.google.com/url?sa=t&rct=j&q=&esrc=s&source=web&cd=&ved=2ahUKEwjUh5rK9bX6AhVwx4sKHei5CzkQwqsBegQIBhAB&url=https%3A%2F%2Fwww.youtube.com%2Fwatch%3Fv%3DZmYIRWsSUJQ&usg=AOvVaw2DS4103kBgr7Ad5DEVkoZv
Спостереження — цілеспрямоване сприйняття хімічних об’єктів (речовин, їхніх властивостей та перетворень) з метою їх вивчення.
- 1. Потрібно чітко визначити предмет спостереження, тобто те, на що буде спрямовано увагу спостерігача — конкретна речовина, її властивості, те чи інше перетворення речовини тощо.
- 2. Необхідно знати, навіщо потрібно проводити спостереження, тобто чітко сформулювати його мету.
- 3. Потрібно скласти план спостереження. А для цього слід висунути гіпотезу (від грецького «припущення») про те, як буде відбуватись спостережуване явище. Гіпотеза може бути висунута і в результаті спостереження, коли отримано певний результат, який треба пояснити.
Наукове спостереження відрізняється від спостереження в побутовому значенні цього слова. Як правило, наукове спостереження здійснюється у чітко контрольованих умовах, при цьому ці умови можна змінювати за бажанням спостерігача. Зазвичай таке спостереження здійснюється у спеціальних приміщеннях — лабораторіях .
Дослідження, яке здійснюють у чітко визначених та контрольованих умовах, називають експериментом (від латинського «дослід», «спроба»).
Багато спостережень незручно або неможливо здійснювати в природі. Тому у вивченні хімії важливу роль відіграє моделювання. У лабораторних умовах використовують особливі прилади та предмети — моделі (від латинського «зразок»), в яких копіюють лише найбільш важливі, суттєві ознаки об’єкта вивчення.

Мал. Моделі молекул деяких речовин
Моделювання — це вивчення об’єкта за допомогою побудови і вивчення моделей, тобто його замінників або аналогів.
Умовно хімічні моделі можна поділити на дві групи: предметні (моделі атомів, молекул, кристалів) (мал.) і знакові, або символьні (символи хімічних елементів, формули речовин, рівняння реакцій тощо).
Фізичні тіла. Матеріали. Речовини та їх фізичні властивості
- Пригадайте з курсу природознавства, що вам відомо про речовини.
Речовини. БИ вже знаєте, що тіла, які оточують нас і яких існує дуже багато, мають спільну ознаку. Вони складаються з речовин. Проте не з усіх речовин можна виготовити ту чи іншу річ (предмет, тіло). Наприклад, з оцтової кислоти не виготовляють фізичних тіл. Тому поняття «речовина» з року в рік під час вивчення предмета буде конкретизуватися.
Речовина — це те, що характеризується відповідною їй масою, властивостями та займає певний об'єм.
- Назвіть речовини, які вам добре відомі. Для чого вони потрібні людині?
З речовим складаються фізичні тіла (речі). Одна й та сама речовина може утворювати декілька фізичних тіл, які відрізняються формою, розмірами, призначенням. Наприклад, з речовини алюмінію виготовляють дріт для ліній електропередач, ложки, виделки, миски тощо для побутового вжитку, сплави для літакобудування; із поліетилену (пластмаси) — пляшки для мінеральної
води та інших рідни, ручки, пакувальні пакети, мішки, лінійки, підставки, коробки для розфасування продуктів тощо (рис. 26).
Вироби з алюмінію (а) і поліетилену (б)
Речовини або їх суміші, що використовуються для виготовлення фізичних тіл, предметів ужиткового та виробничого характеру, називають матеріалами.
Між речовинами, фізичними тілами й матеріалами існують певні зв’язки. Без речовин не існує матеріалів, а матеріали, у свою чергу, є тим, із чого виготовляють фізичні тіла.
- Наведіть приклади таких взаємозв'язків.
Алюміній, поліетилен — не чисті речовини. Вони складаються: перша — з атомів Алюмінію, друга — з молекул поліетилену. Кожна з цих речовин має сталі, характерні лише для неї властивості.
- Пригадайте й назвіть декілька властивостей кухонної солі, цукру.
Властивості речовин. Під час відкриття тієї або іншої речовини, вивчення чи дослідження її властивостей можна з’ясувати, що кожна речовина виявляє якісь особливості. Бони надають речовинам індивідуальних ознак, завдяки чому їх можна відрізнити одну від одної. Ці особливості виявляються у фізичних і хімічних властивостях речовин.
Властивості речовин — це ознаки, що визначають відмінність однієї речовини від іншої або подібність між ними.
За якими ж ознаками можна охарактеризувати фізичні властивості речовин? Це колір, блиск, смак, запах, густина, температури кипіння та плавлення, тепло- й електропровідність, неелектропровідність, твердість, крихкість, пластичність. Так, кольором відрізняються розчини купрум (ІІ) сульфату й амоній біхромату ; різними за густиною є олія та вода
Так, світлові промені не мають маси, а тому не відносяться до тіл.
Вам добре відомі такі тіла як сніжинка, крига, крапля роси утворюються з однієї речовини – води.
Речовини, які використовують для виготовлення предметів, обладнання, а також у будівництві та інших галузях прийнято називати матеріалом.
Для виробництва фізичних тіл використовують найрізноманітніші матеріали: деревину, глину, метали, пластмаси, ґуму, кераміку і скло. Майже всі матеріали, що використовуються людьми, мають природне походження і тому називають природними. Природні матеріали можна піддати обробці, з’єднувати з іншими речовинами та одержувати із них штучні чи синтетичні матеріали. Деревина, яку ми одержуємо з дерев – природний матеріал. Її можна використовувати у чистому вигляді чи після додаткової переробки у вигляді картону та паперу. Скло – це синтетичний матеріал, який одержують шляхом змішування піску, соди, вапняку та іншої сировини при високій температурі.
Для виготовлення того чи іншого тіла потрібен матеріал, який має всі необхідні для цього властивості. Наприклад, стіни будинку повинні бути зроблені з твердого і міцного матеріалу, одяг – з легкого, теплого, чи навпаки, такого що зберігає прохолоду. Усі матеріали мають певний набір властивостей. Для одних характерні міцність і твердість, для інших – пластичність, м’якість. Наприклад, глина – високо пластичний матеріал. У вологому вигляді вона м’яка і пластична. Але після обпалювання в спеціальній печі глина перетворюється на тверду кераміку. А з додаванням інших матеріалів, вона набуває нових властивостей. Пластичними бувають метали при високій температурі, в такому стані з них виготовляють дріт. Такі матеріали, яким можна надати будь-якої форми, називаються пластичними. Матеріали, які після розтягування набувають первісної форми, називаються еластичними, наприклад ґума. Іноді доводиться комбінувати кілька матеріалів з різними властивостями, щоб домогтися потрібного результату. У такому разі їх змішують чи накладають один на один. Наприклад, вікно цокольного поверху має бути прозорим, як звичайне скло і водночас мати міцніть сталі. У цьому разі між двома спеціальними шарами скла прокладають металеву сітку (рис. 25.). Таке скло має високу прозорість і є надміцним.
Рис. 25. Цокольне скло.
Часто назви матеріалу і речовини, з якого складається фізичне тіло, збігаються, оскільки речовина, з якої виготовляють тіло, є матеріалом. Різні тіла можуть бути виготовлені з одного і того ж матеріалу. Так, алюмінієва ложка, алюмінієвий дріт, алюмінієва фольга виготовлена з одного матеріалу – алюмінію і тієї ж речовини – алюмінію. Іноді назви речовини і матеріалу не збігаються. Наприклад, лижі, стіл, крісло складаються з одного й того ж матеріалу – деревини, а основна речовина, що утворює деревину – це клітковина, або целюлоза.
Подібні тіла можуть бути виготовлені з різних матеріалів. Так, наприклад, для виготовлення труб однакової форми застосовують метал, скло або пластик.
Фізичні тіла можуть складатися з однієї речовини (скляний посуд – зі скла) або кількох речовин (для виготовлення настінного годинника використовують скло, метал, пластик або деревину). Тому тіл існує більше ніж речовин.
Підсумок
- Тіла – це предмети, що нас оточують.
- Тіла складаються з речовин.
- Фізичні тіла відрізняються між собою за формою, розміром, мають масу, об’єм.
- Речовина – те, із чого складається фізичне тіло. Невід’ємною ознакою речовини є її маса.
- Матеріалом називають речовину, з якої виготовляють тіла.
- Дайте визначення «речовина», «матеріал», «тіло».
- Чим відрізняються поняття «речовина» і «тіло»? Наведіть приклади. Чому тіл більше, ніж речовин?
Цифри і факти
- З однієї тони макулатури можна виготовити 750 кг паперу або 25 тисяч шкільних зошитів.
- 20 тонн макулатури зберігають від вирубування гектар лісу.
Допитливим
В авіаційній і космічній промисловості, в газових турбінах, в установках для хімічної переробки вугілля, де висока температура, використовують композиційні матеріали. Це матеріали, що складаються із пластичної основи (матриці) та наповнювача. Серед композитів виділяють кераміко-металічні матеріали (кермети), норпласти, (наповнені органічні полімери). Як матрицю використовують метали і сплави, полімери, кераміку. Своєю міцністю композити значно перевищують традиційні матеріали.
Домашній експеримент
Хроматографія на папері
Змішайте по краплі синього і червоного чорнил (може бути суміш фарб розчинних у воді, які не взаємодіють між собою). Візьміть листок фільтрувального паперу, нанесіть маленьку краплину суміші в центр паперу, тоді в центр цієї краплі накрапайте води. На фільтрувальному папері почне утворюватися кольорова хроматограма.
Перед виконанням практичної роботи ознайомся з правилами безпеки. Звертайся до цих правил кожного разу, коли самостійно виконуєш хімічний експеримент.
1. Ознайомлення з лабораторним посудом та іншим обладнанням
Зразки хімічного посуду та іншого лабораторного обладнання, яким ти користуватимешся в процесі вивчення хімії, розміщені частково на твоєму лабораторному столі, а частково на демонстраційному столі вчителя. Розглянь їх і знайди їхні зображення на мал. 13. Зверни увагу на назву кожного предмета і спробуй пояснити його призначення. Намалюй у зошиті 2—3 предмети лабораторного посуду чи обладнання і зазнач їх назву. Можеш користуватися при цьому хімічним трафаретом.

Мал. 13. Хімічний посуд та інше лабораторне обладнання: 1 — ступка з товкачиком; 2 — газовідвідні трубки з пробками; 3 — ложка для спалювання речовин; 4 — пробіркотримач; 5 — тигельні щипці; 6 — скляна паличка; 7 — йоржик; 8 — штатив для пробірок; 9 — скляна пластинка; 10 — чашка для випарювання; 11 — пробірка; 12 — хімічна склянка; 13 — колба плоскодонна; 14 — колба конічна; 15 — банка; 16 — склянка з піпеткою; 17 — лійка; 18 — U-подібна трубка; 19 — кристалізатор; 20 — мірний циліндр; 21 — мензурка; 22 — мірна склянка; 23 — піпетка градуйована; 24 — крапельниці; 25 — мірна колба; 26 — круглодонна колба

Мал. 14. Лабораторний штатив: 1 — підставка; 2 — муфта; 3 — стержень; 4 — тримач; 5 — гвинт тримача; 6 — кільце
Робота зі спиртівкою
Перш ніж запалити спиртівку, перевір, чи є в ній спирт та чи щільний і не розтріпаний гніт (мал. 16).
Спирт можна наливати тільки в погашену спиртівку (мал. 17). Якщо спиртівка горить, наливати спирт категорично заборонено!

Мал. 16. Спиртівка: 1 — резервуар зі спиртом; 2 — гніт; 3 — металічна трубка з диском; 4 — ковпачок
Будова полум’я
Запали свічку і спостерігай, як вона горить. Зверни увагу, що полум’я, яке при цьому утворюється, не є однорідним. Воно має три зони. Розглянь мал. 20. Що ти можеш сказати про температуру цих зон? Яка частина полум’я найбільш гаряча? Зроби висновок, яку частину полум’я треба використовувати для нагрівання речовин.

Мал. 20. Будова полум’я
5. Найпростіші операції з речовинами
Більшість дослідів ти будеш виконувати в скляному (рідше — порцеляновому) посуді: пробірках, хімічних стаканах, колбах (див. мал. 13). Аби правильно здійснювати ту чи іншу операцію, треба знати певні правила. Розглянемо найпростіші операції.
Дослід 1. Нагрівання рідини в пробірці
Перед усім зверни увагу, що пробірки з речовинами можна нагрівати безпосередньо в полум’ї (на голому вогні). Пригадай, яку частину полум’я слід використовувати і чому? Правильно, верхню, оскільки вона найбільш гаряча. А тепер починай експеримент.
Налий у пробірку воду на третину об’єму і закріпи їїу лапці штатива (див. мал. 15) або візьми пробіркотримачем (мал. 21).

Мал. 21. Так треба нагрівати речовину в пробірці
Спочатку прогрій усю пробірку, а потім, не виймаючи з полум’я, нагрівай у потрібному місці. Стеж за тим, щоб не перегрівалися стінки пробірки над рідиною. Отвір пробірки, в якій нагрівається речовина, обов’язково спрямовуй у бік від себе і вид тих, хто працює поруч.
Правила поведінки учнів у хімічному кабінеті
- 1. Заходьте до кабінету хімії та лаборантської кімнати лише з дозволу вчителя. Одягніть халат, у разі потреби — захисні окуляри, гумові рукавиці.
- 2. Поводьтеся в кабінеті спокійно, не беріть у руки банки з реактивами чи підготовлені до уроку пробірки.
- 3. Користуйтеся постійним робочим місцем. Змінюйте його тільки з дозволу вчителя.
- 4. Працюйте так, щоб на вашому робочому столі не було зайвих речей, оскільки вони можуть перешкоджати проведенню хімічного експерименту.
- 5. Намагайтеся виконувати лабораторні досліди й практичні роботи самостійно або в парах чи групах, якщо це передбачено умовами їх проведення.
- 6. Починайте роботу лише після того, як перевірите наявність усіх реактивів та обладнання, продумаєте план ваших дій упродовж експерименту й отримаєте дозвіл учителя.
- 7. Спостерігайте результати ваших досліджень і записуйте в зошит спостереження, відповідні рівняння реакцій і висновки зразу ж після виконання досліду.
- 8. Підтримуйте чистоту й порядок на робочому місці.
- 9. Дотримуйтеся правил користування нагрівними приладами, лабораторним штативом, поводження з реактивами й обладнанням.
- 10. Застосовуйте запобіжні засоби під час роботи в кабінеті хімії: не виконуйте непередбачені досліди; не нюхайте невідомі речовини; не зливайте розчини; не вживайте їжу та напої тощо.
- 11. Дізнайтесь, де знаходиться аптечка та яке призначення медикаментів, що в ній містяться. У разі потреби користуйтеся протипожежними засобами.
А тепер ознайомимося з лабораторним посудом та обладнанням, що найчастіше використовуються на уроках хімії.
Дорогі семикласники! Цього навчального року ви розпочинаєте вивчення нового для вас предмета — хімії.
Хімія — цікава і складна наука. Щоб оволодіти нею повною мірою, необхідно не лише засвоїти теоретичний матеріал, а й навчитися застосовувати набуті знання на практиці. Знання з хімії знадобляться вам як для пояснення багатьох природних явищ, так і для розуміння виробничих процесів та використання хімічних речовин у побуті.
Хімію слід вивчати послідовно і дуже уважно, не пропускаючи жодної навчальної теми. Насамперед ви повинні добре засвоїти найважливіші хімічні поняття та хімічні закони, які становлять основу хімічних знань. Для цього вам потрібно уважно читати кожний параграф, виписувати визначення, правила та формули у зошит і запам’ятовувати їх.
Перегляньте відео
https://www.youtube.com/watch?v=AhTMrhOvIDs
Домашнє завдання: п. 1, виготовити коллаж ( плакат) "Хімія в житті людини"
Немає коментарів:
Дописати коментар