Хімія 8 клас 2022-2023 н.р.
https://meet.google.com/kyf -hwgs- pzp - посилання на онлайн уроки (за розкладом)
22.05.2023 - 23.05.2023
15.05.2023 - 16.05.2023
08.05.2023 - 09.05.2023
01.05.2023 - 02.05.2023
24.04.2023 - 25.04.2023
17.04.2023 - 18.04.2023
 |  |  |
Кальцит | Доломіт | Малахіт |
 |  |  |
Крейда | Мармур | Вапняк |
 |  |  |
Гіпс | Мірабіліт | Чилійська селітра |
 |  |  |
Пірит | Галеніт | Кіновар |
 |  |  |
Галіт | Кам'яна сіль | Сильвін |
10.04.2023 - 11.04.2023
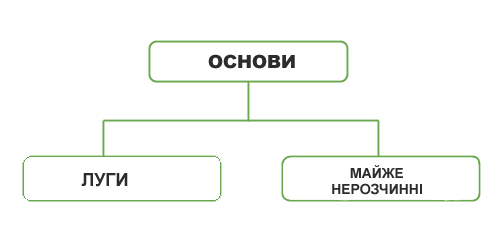
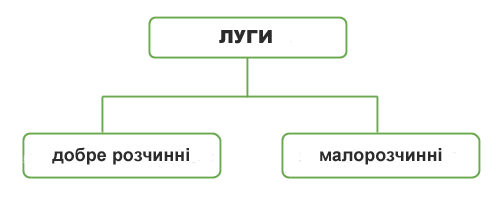
Солі є крихкими кристалічними речовинами. Вони, як правило, мають високі температури плавлення та різну розчинність у воді. Усі солі мають іонну будову.
Для середніх солей характерні такі хімічні властивості.
1. Взаємодія солі з металом з утворенням іншої солі та іншого металу:
CuSO4 + Fe = FeSO4 + Cu
Такі реакції перебігають у водних розчинах, тому для них не можна використовувати метали, які за звичайних умов реагують із водою, наприклад літій, натрій, калій, кальцій, барій та інші активні метали. При складанні рівнянь таких хімічних реакцій необхідно користуватися рядом напруг металів. Більш активні метали можуть витискувати менш активні з розчинів солей. Чим лівіше розташований метал у ряді напруг, тим він є більш активним.
2. Взаємодія солі з кислотою з утворенням іншої солі та іншої кислоти:
K2CO3 + H2SO4 = K2SO4 + CO2 + H2O
У процесі реакції обміну утворюється карбонатна кислота, яка є нестійкою та одразу розпадається з утворенням вуглекислого газу та води:
H2CO3CO2 + H2O
3. Взаємодія розчинів солей з лугами з утворенням іншої основи та іншої солі:
ZnCl2 + 2NaOH = Zn(OH)2¯ + 2NaCl
4. Взаємодія солей з солями:
KCl + AgNO3 = AgCl¯ + KNO3
Реакції такого типу перебігають у розчинах та використовуються для добування практично нерозчинних солей.
Д.З. Опрацюйте матеріал підручника , відеоматеріали. Складіть опорний конспект.
03.04.2023 - 04.04.2023
Кожного дня вдома для приготування їжі ми використовуємо кухонну сіль NaCl. Питну соду NaHCO3 здавна застосовували для миття посуду та приготування смачної випічки. У школі неможливо обійтись без крейди, основна складова якої кальцій карбонат CaCO3.
Усі ці сполуки належать до класу солей.
Солі — це складні речовини, що містять катіони металічних елементів та аніони кислотних залишків.
У формулах солей на першому місці пишуть символ металічного елемента, а потім кислотний залишок
Солі — йонні сполуки. За звичайних умов це тверді речовини, з високими температурами плавлення та кипіння. Солі переважно безбарвні, або, як кажуть, білі. Це, наприклад, хлориди та сульфати Калію, Натрію,
Магнію, Цинку й інші. Деякі можуть бути забарвлені в різні кольори та відтінки: купрум(ІІ) сульфід CuS — чорний; нікель(ІІ) сульфат NiSO4 — зелений; кобальт(ІІ) сульфат CoSO4 — рожевий.
Еле́ктрохімі́чний ряд напру́г, ряд акти́вності (мета́лів) — послідовність елементів в порядку зменшення їхніх стандартних потенціалів окиснення (тобто ступеня легкості віддачі електронів у хімічних реакціях). Термін здебільшого застосовується для порівняння активності металів.
Найпоширеніші елементи розташовуються таким чином (потенціали окиснення наведено у вольтах):
| Li | Cs | Rb | K | Ba | Sr | Ca | Na | Mg | Al | Mn | Zn | H2 | Cu | I- | Ag | Au | F- |
| 3,04 | 2,92 | 2,92 | 2,90 | 2,89 | 2,76 | 2,71 | 2,38 | 2,23 | 1,71 | 1,03 | 0,76 | 0,00 | -0,34 | -0,54 | -0,80 | -1,42 | -2,87 |
Приклади порівняння хімічної активності різних металів[ред. | ред. код]
Якщо залізну пластинку занурити в розчин сульфату міді(II), то залізо буде розчинятись, а мідь виділятися з розчину і осідати тонким шаром на залізній пластинці:
- Fe + CuSO4 → FeSO4 + Cu
Реакція витіснення міді з розчину її солі залізом зводиться до реакції відновлення іонів міді Cu2+ атомами заліза. Атоми при цьому втрачають свої валентні електрони і перетворюються в іони Fe2+
- Fe° - 2e → Fe2+
- Cu2+ + 2e → Cu°
Замість заліза можна взяти нікель, цинк, марганець і взагалі будь-який метал, що стоїть в ряді напруг лівіше від міді. Кожний з них відновлює іони міді до металічного стану, а сам окиснюється і перетворюється у відповідні іони. Звідси виходить, що кожний з цих металів хімічно активніший від міді, тобто легше втрачає свої валентні електрони, будучи сильнішим від неї відновником.
Мідь, у свою чергу, легко витісняє з розчину солі будь-який метал, що стоїть у ряді напруг правіше від неї (ртуть, срібло, золото і ін.), оскільки мідь легше втрачає свої валентні електрони, ніж ці метали. Але мідь не може витіснити з розчину солі жоден з металів, що стоїть у ряду напруг лівіше від неї.
Водень поставлений у ряд напруг металів, бо він, як і метали, утворює позитивно заряджені іони і може витіснятися з розчину кислот (крім нітратної) усіма металами, що стоять у ряді напруг лівіше від нього.
Електрохімічний ряд напруг показує:
- Чим лівіше розміщений метал у ряді напруг, тим він
- хімічно активніший
- сильніший відновник
- легше окислюється
- важче відновлюється з його іонів
- Чим правіше розміщений метал в ряді напруг, тим він
- хімічно менш активний
- слабший відновник
- важче окислюється
- легше відновлюється з його іонів.
- Кожний метал ряду напруг відновлює (витісняє) катіони всіх металів, що стоять у ряді правіше від нього у водних розчинах їх солей.
- Усі метали, що стоять у ряді напруг лівіше від водню, відновлюють (витісняють) його іони у водних розчинах кислот (крім нітратної), а метали, що стоять правіше від нього, не відновлюють.
Електрохімічний ряд напруг показує зміну хімічної активності металів лише у водних розчинах їх солей, а не взагалі. При інших хімічних реакціях — утворенні оксидів, сульфідів, хлоридів тощо — хімічна активність металів змінюється інакше.
- При взаємодії аргентум нітрату з хлоридною кислотою сіль і кислота обмінюються своїми кислотними залишками, і утворюються аргентум хлорид і розчин нітратної кислоти:
- При взаємодії розчину натрій гідроксиду з розчином купрум(
II ) сульфату речовини обмінюються йонами металів, і утворюються натрій сульфат і купрум(II ) гідроксид:
- При взаємодії кислот з лугами утворюються сіль і вода
- При взаємодії цинку з хлоридною кислотою атоми Цинку заміщують атоми Гідрогену хлоридної кислоти. При цьому утворюються цинк хлорид і водень:
- При взаємодії заліза з розчином купрум(
II ) сульфату, атоми Феруму заміщують атоми Купруму. При цьому утворюється мідь і розчин ферум(II ) сульфату:
- При взаємодії ферум(
III ) оксиду з алюмінієм, утворюються алюміній оксид і залізо:
Хімічні властивості кислот. Вам відомо, що до складу неорганічних кислот входять атоми Гідрогену, що є спільним для цього класу сполук, і кислотні залишки.
Наявність у молекулах кислот атомів Гідрогену зумовлює подібні хімічні властивості. Дослідимо їх, використавши хімічний експеримент.
1. Зміна забарвлення індикаторів.
У хімії для визначення кислого або лужного середовища розчинів застосовують розчини індикаторів (рис.), з якими ви вже ознайомлені. У шкільних лабораторіях переважно використовують такі: лакмус, метиловий оранжевий, фенолфталеїн, універсальний індикатор.

Рис. Зміна забарвлення індикаторів у кислотах
Кислоти змінюють забарвлення індикаторів: лакмусу — на червоний, метилового оранжевого — на рожевий, універсальний індикаторний папір набуває червоного кольору.
2. Взаємодія кислот з металами.
Спільною властивістю кислот є їхня взаємодія з металами.
Якщо до порошку магнію долити хлоридну кислоту, відбувається характерне «закипання» суміші через інтенсивне виділення газу водню, що витіснився магнієм з кислоти. Рівняння реакції:
Mg + 2HCl = MgCl2 + H2↑.
Так само виділення водню спостерігається, якщо до гранул цинку долити розчин сульфатної кислоти (рис.):
Zn + H2SO4 (розб.) = ZnSO4 + H2↑.

Рис. Взаємодія цинку із сульфатною кислотою
Рівняння реакцій:
Mg + 2НСl = MgCl2 + H2↑;
Fe + 2HCl = FeCl2 + H2↑;
Cu + 2HCl =
Це дослідження наштовхнуло вчених на думку про те, що хімічна активність металів є неоднаковою. Одні метали проявляють більшу, інші — меншу активність під час хімічних перетворень.
На основі експериментальних досліджень російський учений М. Бекетов розмістив метали у ряд активності металів.

Виявлено, що метали, розміщені в ряді активності до водню, здатні витискувати його з кислот, утворюючи просту речовину водень (виняток — нітратна кислота). П’ять металів, які розміщені після водню, з розчинами кислот не реагують. Кожний наступний метал у ряді є менш хімічно активний, ніж попередній. Самі ж метали заміщають атоми Гідрогену в кислоті. Такий тип реакцій називають реакціями заміщення.
Реакції заміщення — реакції, що відбуваються між простою та складною речовинами, унаслідок чого атоми простої речовини заміщають атоми в складній.
Крім водню, під час реакції утворюється сіль відповідного металу.
• Наведіть самостійно приклади реакцій заміщення та складіть їхні рівняння.
3. Взаємодія кислот з основними оксидами .
Як приклади таких хімічних перетворень наведемо кілька рівнянь реакцій:
MgO + H2SO4 = MgSO4 + H2O;
BaO + 2HNO3 = Ba(NO3)2 + H2O.
На відміну від реакцій заміщення, у процесі взаємодії кислот з основними оксидами беруть участь дві складні речовини. Уважно розглянувши рівняння, побачимо, що під час цих перетворень відбувається обмін між складовими частинками речовин. Такий тип реакцій називають реакціями обміну.
Реакції обміну — реакції між двома складними речовинами, під час яких вони обмінюються складовими частинками.
Д.З. Опрацюйте матеріал підручника , відеоматеріали. Складіть опорний конспект.
Приклади: | Приклади: |
Колір основи | Приклади |
Білий | |
| Жовтий | |
Світло-рожевий (при контакті з киснем повітря забарвлення стає коричневим) | |
| Червоно—коричневий | |
Білий з зеленуватим відтінком (при контакті з киснем повітря забарвлення стає темнішим) | |
| Світло зелений | |
| Синій |
Тема: Фізичні та хімічні властивості оксидів
https://youtu.be/HflB1WIpmDI
3. Кислотні оксиди можуть реагувати з основними (та амфотерними) оксидами, утворюючи солі.
Тема: Оксиди, їх склад, назва. Властивості. Оксиди в природі. Класифікація оксидів. Використання оксидів.
https://youtu.be/Pzu_OvcSNCo - оксиди
Поширеність оксидів у природі. Оксиди — хімічні сполуки, які дуже часто трапляються в природі. В основному до них належать сполуки активних металічних і неметалічних елементів.
Вода — найпоширеніший оксид на Землі Вона заповнює всі западини земної поверхні, утворюючи ріки, озера, моря й океани. Просочуючись у ґрунт, вона утворює ґрунтові й підземні води. Ця дивовижна речовина входить до складу гірських порід і мінералів. Розчиняючи в собі деякі потрібні для здоров’я людини солі, утворює цілющі мінеральні джерела, біля яких розташовані курорти й лікувальні заклади.

Вода в трьох станах: а — рідкому; б — твердому; в — газоподібному
Без води не можуть існувати живі організми — людина, рослини, тварини. В організмі людини вода бере участь у всіх біохімічних процесах, підтримує об’єм і пружність клітин.
Для життя та підтримування здоров’я людині потрібна чиста вода, без домішок шкідливих речовин, що потрапляють у водойми внаслідок господарської діяльності. Тому всі люди, які живуть на нашій планеті, мають берегти воду — це справжнє чудо природи, чиї таємниці ще не до кінця розкриті.
Силіцій(IV) оксид теж належить до найбільш поширених природних оксидів. Насамперед це пісок. У природі він залягає окремими пластами, а також устилає дно водойм: річок, морів, океанів. Крім піску, природа подарувала людині й прозорий мінерал кварц Деякі його кристали сягають гігантських розмірів. Кварц утворює багато кристалічних різновидів: гірський кришталь, димчастий кварц, аметист, котяче око та ін., які завдяки домішкам мають різноманітне забарвлення. Кварц використовують у різних приладах — оптичних, електронних, теле- й радіоапаратурі, для виготовлення кварцового скла, як дорогоцінні камені в ювелірній справі тощо.
Алюміній оксид є складовою природних мінералів алюмосилікатів. До них належать польовий шпат К2О · Аl2О3 · 6SiO2 і коалініт Аl2О3 · 2SiO2 · 2Н2О. Алюміній оксид входить до складу бокситу — мінералу, з якого видобувають алюміній. Мінерал корунд, що має високу твердість, використовують для виготовлення шліфувальних кругів. Він утворює два кольорові різновиди: рубін (рис. 58), що має інтенсивне червоне забарвлення, і сапфір — синього кольору, які використовують для виготовлення дорогоцінних прикрас.
 Рубін
Рубін
Ферум оксиди входять до складу відомих у металургії залізних руд, яких є досить багато. У металургійній промисловості найчастіше використовують червоний залізняк, до складу якого входить ферум(ІІІ) оксид Fe2O3 (рис. 59, а), відомий як руда гематит. Ферум(ІІ, ІІІ) оксид Fe3О4 (рис. 59, б) є основною складовою магнітного залізняка. Руда магнетит містить до 72,4 % Феруму.

Ферум оксиди: а — ферум(ІІІ) оксид; б — ферум(ІІ, ІІІ) оксид
У природі трапляються й інші залізняки, зокрема бурі й шпатові, однак їхні руди мають інший хімічний склад. Усі мінерали, що містять елемент Ферум, є основною сировиною для виробництва заліза та його сплавів.
Магній оксид у природі — це мінерал периклаз. Магній оксид MgO (рис. 60) ще називають паленою магнезією, що пов’язано зі способом її добування в промисловості. Магній оксид є у складі таких сполук, як тальк 3MgO · 4SiO2 · H2O й азбест CaO · MgO · 4SiO2. Вони мають високу вогнестійкість.

Магній оксид
Карбон(IV) оксид поширений в атмосфері. Приблизно 0,03 % цього газу входить до складу повітря. Відіграє активну роль у процесі фотосинтезу. Накопичення вуглекислого газу в повітрі спричиняє парниковий ефект.
Використання оксидів. Частково про використання оксидів уже згадувалося. Широкий спектр використання цих сполук залежить насамперед від різноманітності їхніх фізичних і хімічних властивостей. Докладнішу інформацію про використання оксидів містить таблиця
Таблиця
Використання оксидів
Назва | Формула | Використання |
Гідроген оксид (вода) | H2O | Для виробництва кисню та водню; охолодження ядерних реакторів; виготовлення розчинів речовин, напоїв; для вироблення електроенергії; миття й прання; приготування їжі. Крім того, у виробництві мінеральних добрив, хімічних сполук. Для лікуваня використовують мінеральні води цілющих джерел. |
Кальцій оксид (негашене вапно) | CaO | Для добування гашеного вапна, що, як і негашене, використовують як будівельний матеріал; хлорного вапна; для вапнування ґрунтів; у хімічних лабораторіях; для виробництва скла, цементу, кераміки. |
Силіцій(IV) оксид (кремнезем) | SiO2 | У силікатній промисловості: виробництво скла, цементу, бетону, цегли, керамічної плитки; для виготовлення термостійкого посуду, кварцового скла. Використовують також як будівельний матеріал. Мінерал кварц — для виготовлення лінз, ювелірних прикрас, деталей годинників, спецодягу. |
Алюміній оксид (боксит) | Al2O3 | Для виплавляння алюмінію та його сплавів, які застосовують у літако-, ракето- й машинобудуванні; виробництва абразивних матеріалів, штучних корундів, ювелірних виробів. |
Назва | Формула | Використання |
Ферум(ІІ, ІІІ) оксид (магнетит) | Fe3O4 | Для виплавляння заліза, найпоширеніших сплавів — чавуну та сталі. |
Магній оксид | MgO | Для виробництва гуми. У керамічній промисловості — для виробництва вогнетривкої цегли. Палену магнезію використовують у медичній практиці для виготовлення таблеток і капсул, у харчовій промисловості — як емульгатор і харчову добавку (Е-530). |
У таблиці наведено неповний перелік використання оксидів. Вивчаючи хімічні властивості оксидів, ви ознайомилися з реакціями їхньої взаємодії з водою. На цих реакціях ґрунтується добування основ і кислот. Під час взаємодії основних і кислотних оксидів між собою утворюються солі. Солі ж добувають і шляхом реакцій основних оксидів з кислотами та кислотних оксидів — з основами.
ПІДСУМОВУЄМО ВИВЧЕНЕ
• Оксиди — хімічні сполуки, які часто трапляються в природі. Це оксиди активних металічних і неметалічних елементів.
• Вода — найпоширеніший на Землі оксид.
• До поширених оксидів належать оксиди Феруму, Алюмінію, Кальцію, Силіцію тощо.
• Оксиди широко використовують в усіх галузях господарства, що зумовлено їхніми різноманітними фізичними та хімічними властивостями.
Д.З. Опрацюйте матеріал підручника , відеоматеріали, матеріали сайту.
Задача 1
П’ятачок на день народження друга вирішив надути повітряні кульки. Допоможіть йому обчисліть об’єм Гелію, кількістю речовини 3,5 моль.
Задача 2
Вчителька за урок витрачає 15 г крейди. Обчисліть кількість речовини та кількість молекул CaCO3.
Задача 3
Для приготування вечері Попелюшка використовує 1,5 моль NaCl. Обчисліть масу та кількість молекул солі.
Задача 4
Водяний в своєму ставку має 3000·1023 молекул води. Обчисліть масу та об’єм води в ставку.
Задача 5
Фея квітів має 150·1023 молекул чарівного пилу. Обчисліть кількість речовини та об’єм чарівного пилу.
Задача 6
Для приготування варення Карлсону потрібно 515 грам цукру. Обчисліть кількість речовини та кількість молекул цукру С12Н22О11.
Задача 7
Допоможіть Мауглі порахувати, яку кількість речовини та масу кисню виробляють дерева в джунглях, якщо відомо, що загальний об’єм O2 складає 5600 літрів.
Задача 8
Для боротьби з Десиптиконами людству вкрай необхідні кислоти HNO3 та H2SO4 масою 900 г та 750 г відповідно. Обчисліть к кількість речовини кислот.
( та об’єм, якщо r= 1,51 та r=1,84 вiдповiдно)
Задача 9
Дракон у своєму сховищі має 12000 · 1023 атомів золота та 9000 · 1023 атомів срібла. Обчисліть загальну масу його скарбів.
Задача 10
Для оборотного зілля Гаррі Потерру потрібно взяти 7 моль сірководню H2S. Допоможіть обчисліть, які необхідні об’єм та маса газу?
Д.З. Опрацюйте матеріал підручника , відеоматеріали, матеріали сайту (попередні відео та матеріали) . Виконані 10 задач = самостійній роботі з теми"Кількість речовини.
1 моль будь-якого газу за н. у. займає об’єм 22,4 л. Цей об’єм називають молярним об’ємом. Молярний об’єм чисельно дорівнює об’єму 1 моль речовини і позначається Vm («ве-ем»):
Vm = 22,4 л/моль, м3/моль.
Оскільки число молекул однакове, вага рівних об’ємів газів пропорційна молекулярним масам узятих речовин.
Молярний об’єм газу (Vm) визначається за відношенням об’єму (V) порції даного газу до кількості речовини (n) в цій порції: Vm = V / υ, де V – об’єм газу за н. у., (л, м3); ν – кількість речовини газу, (моль).
Отже, молярний об’єм газу вимірюється в літрах на моль (л/моль) або кубічних метрах на моль (м3/моль).
Визначення молярного об’єму газу за кількістю речовини і об’ємом
Приклад 22. Обчисліть молярний об’єм газу, 3 моль якого займають об’єм 67,2 л.
Дано: υ(газу) = 3 моль | Vm = V/ν; | Розв’язання: Обчислюємо молярний об’єм газу: |
Vm(газу) – ? |
Відповідь: Vm(газу) = 22,4 л/моль.
Молярний об’єм газу можна обчислити також, знаючи молярну масу газу та його густину ρ, тобто масу 1 л даного газу за нормальних умов.
Визначення молярного об’єму газу за густиною
Приклад 23. Обчисліть молярний об’єм амоніаку (NH3), маса 1 л якого за нормальних умов важить 0,76 г.
Дано: ρ(NH3) = 0,76 г/л | M(NH3) = 17 г/моль | Розв’язання: Обчислюємо молярний об’єм амоніаку: |
Vm(NH3) – ? |
Відповідь: Vm(NH3) = 22,4 л/моль.
Знаючи молярний об’єм газів, можна визначити: а) об’єм газу за відомою кількістю речовини; б) кількість речовини газу за відомим об’ємом; в) масу 1 літра газу, виміряного за нормальних умов, за відомою молярною масою; г) об’єм газу за відомою густиною та масою:
V = υ • Vm | υ = V / Vm | m = M / 22,4 | V = m / ρ |
Визначення об’єму газів
а) за кількістю речовини газу
Приклад 24. Обчисліть об’єм кисню кількістю речовини 2 моль.
Дано: n(O2) = 2 моль | V = υ • Vm | Розв’язання: Обчислюємо об’єм кисню кількістю речовини 2 моль: |
V(O2) – ? |
Відповідь: V(O2) = 44,8 л.
++++
Відносна густина газів – це відношення молярних мас двох газів, що займають однакові об’єми.
1. 2. 3.
|
|
|
| Якщо
|
Фізичний зміст відносної густини газів показує у скільки разів один газ важчий або легший за інший. З формул 2 і 3 можна визначити молярну і відносну молекулярну маси.
![]() або
або ![]()
Відносну густину газів обчислюють за будь-яким газом. Найчастіше визначають за воднем, киснем, повітрям.
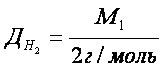
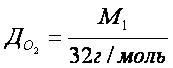
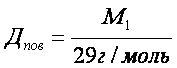
Д.З. Опрацюйте матеріал підручника , відеоматеріали, матеріали сайту.
09.01.2023 - 10.01.2023
М(К) = 39 г/моль; М(N2) = 28 г/моль;
М(Н2О) = 18 г/моль; М(К2О) = 94 г/моль; М(S) = 32 г/моль; М(Н2SО4) = 98 г/моль.
Молярну масу можна визначити за формулами:
| M = m0•NA | М = ρ•Vm | M = 2Дн2 |
m0 – абсолютна маса речовини; ρ – густина речовини.
Визначення молярної маси речовин
1. За формулою речовини
Приклад . Визначте молярну масу алюміній оксиду (Al2O3).
Дано: Al2O3 | M = Mr | Розв’язання: M(Al2O3) = 2Ar(Al) + 3Ar(O) = 2 • 27 + 3 • 16 = 54 + 48 = 102 (г/моль). |
M(Al2O3) – ? |
Відповідь: М(Al2O3) = 102 г/моль.
2. За відомою кількістю речовини і масою
Молярна маса – це фізична величина, що дорівнює відношенню маси речовини до відповідної кількості речовини: , де m – маса речовини (г); ν – кількість речовини (моль).
Приклад . Обчисліть молярну масу барій оксиду 3 моль якого важать 459 г.
Дано: ν(ВаО) = 3 моль | Розв’язання: Обчислюємо молярну масу барій оксиду: | |
М(ВаО) – ? |
Відповідь: М(ВаО) = 153 г/моль.
Приклад . Обчисліть молярну масу газу 2 моль якого важать 88 г.
Дано: ν(газу) = 2 моль | Розв’язання: Обчислюємо молярну масу газу: | |
М(газу) – ? |
Відповідь: М(газу) = 44 г/моль.
1. Ступінь окиснення може бути позитивним, негативним або дорівнювати нулю. Він позначається арабською цифрою зі знаком «плюс» або «мінус» над символом елемента.
2. При визначенні ступенів окиснення виходять з електронегативності речовини: сума ступенів окиснення всіх атомів у сполуці дорівнює нулю.
3. Якщо сполука утворена атомами одного елемента (в простій речовині), то ступінь окиснення цих атомів дорівнює нулю.
4. Атомам деяких хімічних елементів звичайно приписують сталі ступені окиснення. Наприклад, ступінь окиснення Флуору в сполуках завжди дорівнює –1; Літію, Натрію, Калію, Рубідію і Цезію +1; Магнію, Кальцію, Стронцію, Барію і Цинку +2, Алюмінію +3.
5. Ступінь окиснення Гідрогену у більшості сполук +1, і лише в сполуках з деякими металами він дорівнює –1 (KH, BaH2).
6. Ступінь окиснення Оксигену у більшості сполук –2, і лише в деяких сполуках йому приписують ступінь окиснення –1 (H2O2, Na2O2 або +2 (OF2).
7. Атоми багатьох хімічних елементів виявляють змінні ступені окиснення.
8. Ступінь окислення атома металу в сполуках позитивний і чисельно дорівнює його валентності.
9. Максимальний позитивний ступінь окиснення елемента, як правило, дорівнює номеру групи в періодичній системі, в якій знаходиться елемент.
10. Мінімальний ступінь окиснення для металів дорівнює нулю. Для неметалів у більшості випадків нижчий негативний ступінь окиснення дорівнює різниці між номером групи та цифрою вісім.
11. Ступінь окиснення атома, що утворює простий іон (складається з одного атома), дорівнює заряду цього іона.
Користуючись наведеними правилами, визначимо ступені окиснення хімічних елементів у сполуці H2SO4. Це складна речовина, яка складається з трьох хімічних елементів – Гідрогену Н, Сульфуру S та Оксигену О. Зазначимо ступені окиснення тих елементів, для яких вони є сталими. У нашому випадку це Гідроген Н та Оксиген О:
.
Визначимо невідомий ступінь окиснення Сульфуру. Нехай ступінь окиснення Сульфуру в цій сполуці дорівнює х: .
Складемо рівняння, помноживши для кожного елемента його індекс на ступінь окиснення та добуту суму прирівняємо до нуля: 2 · (+1) + x + 4 · (-2) = 0
+2 + x - 8 = 0
x = +8 – 2 = +6
Отже, ступінь окиснення Сульфуру дорівнює плюс шість: .
У наступному прикладі з’ясуємо, як можна скласти формулу сполуки за відомими ступенями окиснення атомів елементів. Складемо формулу ферум(III) оксиду. Слово «оксид» означає, що справа від символу Феруму треба записати символ Оксигену: FeO.
Зазначимо ступені окиснення хімічних елементів над їх символами. Ступінь окиснення Феруму вказана в назві в дужках (III), отже, дорівнює +3, ступінь окиснення Оксигену в оксидах –2 : .
Знайдемо найменше спільне кратне для чисел 3 та 2, це 6. Розділемо число 6 на 3, одержимо число 2 – це індекс для Феруму. Розділемо число 6 на 2, одержимо число 3 – це індекс для Оксигену: .
У наступному прикладі з’ясуємо, як можна скласти формулу сполуки за відомими ступенями окиснення атомів елементів та зарядами іонів. Складемо формулу кальцій ортофосфату. Слово «ортофосфат» означає, що справа від символу Кальцію треба записати кислотний залишок ортофосфатної кислоти: CaPO4.
Зазначимо ступінь окиснення Кальцію (правило номер чотири) та заряд кислотного залишку (за таблицею розчинності): .
Знайдемо найменше спільне кратне для чисел 2 та 3, це 6. Розділемо число 6 на 2, одержимо число 3 – це індекс для Кальцію. Розділемо число 6 на 3, одержимо число 2 – це індекс для кислотного залишку: .
- 1. Визначте ступені окиснення елементів у сполуках, хімічні формули яких N2O, NO, N2O3, NO2, N2O5, PCl3, ClO2, K3N.
- 2. Виберіть формули тих сполук, у яких Сульфур виявляє ступінь окиснення -2: SO2; CS2; SF6; SO3; MgS.
- 3. Виберіть формули сполук, у яких Гідроген виявляє ступінь окиснення -1: H2S; СаН2; LiH; NH3; АlН3; НСl.
- 4. Виберіть формули сполук, у яких ступені окиснення елементів дорівнюють 0: CO; Cl2; Zn; SO2; Li.
- 5. Виберіть формули сполук, у яких атоми Флуору мають однаковий ступінь окиснення: F2; OF2; HF; KF; MgF2.
- 6. Виберіть формулу сполуки, у якій Сульфур виявляє ступінь окиснення +4: SO3; SO2; H2S; K2S.
- 7. Виберіть хімічний елемент, який ніколи не виявляє позитивний ступінь окиснення: О; Н; S; F; Na; N.
- 8. *Визначте ступені окиснення хімічних елементів у речовинах, формули яких H2SO3; NaOH; НСlО4; С2Н6; С2Н5ОН.
- 1. Визначте ступені окиснення елементів у сполуках, хімічні формули яких N2O, NO, N2O3, NO2, N2O5, PCl3, ClO2, K3N.
- 2. Виберіть формули тих сполук, у яких Сульфур виявляє ступінь окиснення -2: SO2; CS2; SF6; SO3; MgS.
- 3. Виберіть формули сполук, у яких Гідроген виявляє ступінь окиснення -1: H2S; СаН2; LiH; NH3; АlН3; НСl.
- 4. Виберіть формули сполук, у яких ступені окиснення елементів дорівнюють 0: CO; Cl2; Zn; SO2; Li.
- 5. Виберіть формули сполук, у яких атоми Флуору мають однаковий ступінь окиснення: F2; OF2; HF; KF; MgF2.
- 6. Виберіть формулу сполуки, у якій Сульфур виявляє ступінь окиснення +4: SO3; SO2; H2S; K2S.
- 7. Виберіть хімічний елемент, який ніколи не виявляє позитивний ступінь окиснення: О; Н; S; F; Na; N.
- 8. *Визначте ступені окиснення хімічних елементів у речовинах, формули яких H2SO3; NaOH; НСlО4; С2Н6; С2Н5ОН.
Залежно від природи частинок, розташованих у вузлах, і характеру зв'язку між ними, розрізняють чотири типи кристалічних ґраток: йонну, металічну, атомну і молекулярну.
Експериментальні дані підтверджують ці припущення: температури плавлення
Атом металу легко віддасть свій слабо зв'язаний з ядром валентний електрон атому неметалу, який надасть йому вільне місце на зовнішньому енергетичному рівні. Обидва в результаті отримають заповнені зовнішні рівні.
Атом металу при цьому отримає позитивний заряд, а атом галогену перетвориться в негативно заряджену частинку. Такі частинки називаються йонами.
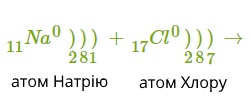
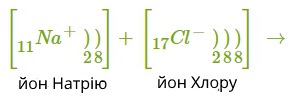


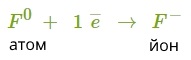

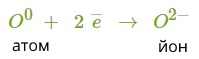
Що примушує атоми сполучатися один з одним? Як пояснити, наприклад, що молекула водню Н2 і хлору Cl2 складається із двох атомів, а не трьох, а молекула Гелію Не2 не існує? Чому одні атоми сполучаються між собою, а інші — ні? Чому деякі молекули стійкі, інші легко розпадаються, а треті взагалі ніколи не утворюються за жодних умов? Відповіді на ці і подібні питання надзвичайно важливі для хіміків.
У ХІХ ст. було введено поняття валентності як число хімічних зв'язків, які атом утворює з іншими атомами. Наприклад, знаючи, що валентність Гідрогену дорівнює І, а Оксигену — ІІ, можна скласти структурні формули молекул водню, кисню і води:
![]()
у яких рисками позначені хімічні зв'язки між атомами.
Що ж це таке — хімічний зв'язок? Відповісти на питання вдалося тільки тоді, як було вивчено будову атома. У 1897 р. англійський фізик Дж. Дж. Томсон висловив припущення, що зв'язок має електричну природу і утворюється за рахунок зміщення чи переходу електронів від одного атома до іншого. Ця гіпотеза виявилася правильною.
Атом, як ви вже знаєте, складається із позитивно зарядженого ядра і електронів. Найпростіший атом — атом Гідрогену — має всього один електрон, який міститься на першому енергетичному рівні. Під час зближення двох атомів ядро одного з них притягує електронну хмару іншого і навпаки.
Між атомами виникає взаємодія, і відстань між ними зменшується доти, доки взаємне притягання не урівноважується відштовхуванням між ядрами. В утвореній молекулі електронна густина в просторі між ядрами є найбільшою. Дві електронні хмари атомів об'єднуються в єдину електронну хмару молекули (мал).

Внаслідок перекривання електронних хмар атомів Гідрогену утворюється електронна хмара молекули водню
Молекула може утворитися тільки тоді, коли при взаємодії атомів їхня загальна енергія зменшується. Інакше кажучи, утворення хімічного зв'язку завжди супроводжується виділенням енергії, яку називають енергією хімічного зв'язку.
Хімічний зв'язок — це взаємодія атомів або будь-яких інших частинок, в результаті якої виникають стійкі утворення — молекули, йони, кристали тощо.
Не всі атоми можуть взаємодіяти між собою. Буває так, що при зближенні атомів і перекриванні їхніх електронних хмар молекула не утворюється. Наприклад, якщо два атоми Гелію наближаються один до одного, то загальна енергія весь час збільшується, і молекула Не2 утворитися не може.
Умови виникнення хімічного зв'язку визначив американський хімік Г. Льюїс, який у 1916 р. запропонував електронну теорію хімічного зв'язку. Ця теорія ґрунтується на уявленні про те, що електронні оболонки атомів інертних елементів мають особливу стійкість, чим і пояснюється їхня хімічна інертність (див. § 12). Атоми всіх інших елементів при утворенні хімічного зв'язку намагаються змінити електронну оболонку до конфігурації найближчого інертного елемента, віддаючи чи приєднуючи електрони. Тільки в цьому разі утворюються стійкі молекули. Льюїс назвав це твердження правилом октету (від лат. окто — вісім), оскільки атоми всіх інертних елементів, крім Гелію, містять на зовнішньому енергетичному рівні вісім електронів.
Тепер зрозуміло, чому утворюється молекула Н2, а молекула Не2 — ні. Це пояснюється тим, що атому Гідрогену до завершення зовнішнього рівня не вистачає одного електрона. Під час утворення молекули Н2 електрони двох атомів об'єднуються, електронна конфігурація кожного атома доповнюється до конфігурації атома Гелію. В той же час в атомі Гелію зовнішній енергетичний рівень уже завершений; його атомам просто не потрібні «чужі» електрони.
2. Електронегативність елементів
З погляду теорії будови атома належність хімічних елементів до металічних чи неметалічних визначається здатністю їхніх атомів віддавати чи приєднувати електрони під час хімічних реакцій.
Властивість атома притягувати валентні електрони інших атомів називають електронегативністю.
Найсильніше притягують електрони атоми типових неметалічних елементів: Флуору, Оксигену, Хлору, адже їм до завершення зовнішнього енергетичного рівня не вистачає 1 чи 2 електрони. Тому їхня електронегативність найбільша. Як ви пам'ятаєте, найлегше віддають електрони атоми лужних елементів: Літію, Натрію, Калію тощо. Вони мають найменшу електронегативність. За електронегативністю атоми хімічних елементів можна розмістити в ряд, який розпочинається найактивнішими неметалічними елементами і завершується найактивнішими металічними елементами:
F, O, N, Cl, Br, I, S, C, P, H, B, Si, Fe, Cr, Zn, Be, Al, Mg, Ca, Li, Sr, Na, Ba, K, Rb, Cs
Шкалу для визначення електронегативності розробив американський хімік Л. Полінг. За шкалою Полінга електронегативність Флуору дорівнює 4,0, на другому місці — Оксиген, на третьому — Нітроген.
Таблиця
ВІДНОСНА ЕЛЕКТРОНЕГАТИВНІСТЬ ДЕЯКИХ ХІМІЧНИХ ЕЛЕМЕНТІВ
Група/Період | I | II | III | IV | V | VI | VII | VIII |
1 | H 2,1 | |||||||
2 | Li 1,0 | Be 1,5 | B 2,0 | C 2,5 | N 3,0 | О 3,5 | F 4,0 | |
3 | Na 0,9 | Mg 1,2 | Al 1,5 | Si 1,8 | P 2,2 | S 2,5 | Cl 3,0 | |
4 | K 0,8 | Ca 1,0 | Br 2,8 | |||||
5 | Rb 0,8 | Sr 0,9 | I 2,5 | |||||
6 | Cs 0,7 | Ba 0,8 |
(Числові значення у таблиці дано дуже наближено).
Гідроген і типові неметалічні елементи розміщені всередині шкали; значення їхньої електронегативності близьке до 2. Активні металічні елементи мають значення електронегативності менше ніж 1,6.
У періодичній системі зміна електронегативності елементів співпадає зі зміною неметалічних властивостей: у періоді зліва направо зростає і зменшується у головній підгрупі зверху донизу.
ВИСНОВКИ
• Сполучення атомів у молекулу супроводжується виділенням енергії. Хімічний зв'язок — це взаємодія атомів або будь-яких інших частинок, в результаті якої виникають стійкі утворення — молекули, йони, кристали тощо.
• Під час утворення хімічного зв'язку атоми намагаються змінити зовнішній енергетичний рівень до октету (восьми електронів), віддаючи і приймаючи електрони або утворюючи спільні електронні пари.![]()
• Властивість атома притягувати валентні електрони інших атомів називають електронегативністю.
Його утворення може відбуватись як з атомів одного елемента, так і з атомів різних хімічних елементів.
Утворення ковалентного неполярного зв'язку. Розглянемо, як утворюється ковалентний зв'язок між однаковими атомами.
Приклад 1. Утворення молекули водню.
Молекула водню складається з двох атомів Гідрогену, що мають найпростішу будову електронної оболонки.
![]()
Щоб зовнішня і єдина s-орбіталь атома Гідрогену стала завершеною, потрібен ще один електрон. Тож два атоми Гідрогену утворюють одну спільну електронну пару. (Відомо, що в спільній електронній парі електрони мають різний напрям обертання навколо своєї осі.) Між двома атомами Гідрогену на певній відстані відбувається перекривання їхніх s-орбіталей. Цей процес супроводжується виділенням енергії та утворенням спільної електронної пари, що одночасно належить обом атомам. Місце перекривання електронних орбіталей має підвищену електронну густину, тому до неї притягуються позитивно заряджені ядра обох атомів (мал).

Мал. Перекривання s-орбіталей з утворенням спільної електронної пари в молекулі водню
З наближенням ядер починають діяти сили відштовхування (однойменно заряджені частинки відштовхуються, різнойменно заряджені — притягуються). На певній відстані ці сили врівноважуються, ядра та електрони стають єдиною стійкою системою. Так утворюється молекула водню, формула якої Н2.
Оскільки хімічний зв'язок у молекулі водню утворився між атомами одного хімічного елемента, електронегативність яких однакова, то ядра обох атомів мають однаковий вплив на спільну електронну пару. Тому вона рівновіддалена від центрів ядер обох атомів і не зміщується в бік одного з них. Це передають за допомогою електронної формули молекули, в якій записують символи хімічних елементів та позначені крапками електрони зовнішнього енергетичного рівня.
Утворення молекули водню змодельовано на схемі

Схема. Модель утворення молекули водню
Електронна формула молекули — це запис складу речовини за допомогою символів хімічних елементів та крапок, що позначають електрони зовнішнього енергетичного рівня.
На електронних формулах чітко видно, скільки спільних електронних пар має молекула.
Рівне віддалення спільної електронної пари від ядер атомів, між якими виник ковалентний зв'язок, означає, що зв'язок неполярний.
Ковалентний неполярний зв'язок — це зв'язок за допомогою спільних електронних пар, які рівновіддалені від ядер обох атомів.
Приклад 2. Утворення молекули кисню О2.
Молекула кисню, як і молекула водню, складається з двох атомів одного хімічного елемента. Хімічний елемент Оксиген має таку будову електронної оболонки атома:
![]()
Це можна передати електронною формулою молекули.

Як бачимо, на зовнішньому енергетичному рівні кожного атома міститься шість електронів, серед яких два неспарені. Для утворення стійкого 8-електронного зовнішнього енергетичного рівня не вистачає ще двох електронів. Тому два неспарені електрони одного атома утворюють дві спільні електронні пари з двома неспареними електронами іншого атома. За рахунок спільних електронних пар досягається завершеність зовнішнього енергетичного рівня кожного атома в молекулі кисню.
Зверніть увагу на те, що в молекулі водню атоми Гідрогену досягли утворення зовнішнього енергетичного рівня атома інертного елемента Гелію. У молекулі кисню електронні оболонки обох атомів Оксигену мають завершений другий, він же зовнішній, енергетичний рівень із 8 електронів. Рівно стільки ж електронів є на зовнішньому енергетичному рівні в атома інертного хімічного елемента Неону, яким завершується другий період.
Зв'язок атомів Оксигену в молекулі кисню теж ковалентний неполярний.
Замінивши кожну спільну пару електронів в електронних формулах молекул водню та кисню на риски, одержимо структурні формули.
![]()
Одна риска позначає одну одиницю валентності.
Із структурних формул стає зрозуміло, що валентність дорівнює числу спільних електронних пар.
УТВОРЕННЯ КОВАЛЕНТНОГО ПОЛЯРНОГО ЗВ'ЯЗКУ. Розглянемо, як утворюється ковалентний зв'язок між атомами різних неметалічних елементів.
Приклад 3. Утворення молекули гідроген хлориду (хлороводню) HCl.
Молекула гідроген хлориду, як і молекули водню та кисню, складається з двох атомів, проте вони мають різну електронегативність. Зверніть увагу на розміщення Гідрогену та Хлору в ряді електронегативності (с. 105), і ви побачите, що Хлор розміщено на початку ряду, тоді як Гідроген — майже посередині.
Виходячи з електронної будови атомів Гідрогену та Хлору, розглянемо, як між ними утворюється хімічний зв'язок.

Незважаючи на те, що в атома Хлору на зовнішньому енергетичному рівні 7 електронів, він може утворити з іншими атомами лише одну спільну електронну пару (за кількістю неспарених електронів). За рахунок спільної електронної пари атом Гідрогену досягне утворення завершеного зовнішнього енергетичного рівня атома інертного хімічного елемента Гелію, а атом Хлору — Аргону.
Чим далі один від одного розташовані хімічні елементи в ряді електронегативності, тим більшим буде зміщення спільних електронних пар до більш електронегативного атома. Користуючись цим правилом, робимо висновок про те, що електрони спільної електронної пари Гідрогену й Хлору будуть зміщені в бік атома Хлору. Схематично її утворення й електронну формулу молекули можна передати так:

На схемі відображено зміщення спільної електронної пари в бік більш електронегативного Хлору. Утворилася молекула, в якій атоми зв'язані силою притягування позитивно заряджених ядер атомів до негативно зарядженого місця перекривання s-орбіталі атома Гідрогену та р-орбіталі атома Хлору (мал).

Мал. Утворення молекули HCl
Хімічний зв'язок за допомогою спільних електронних пар, які зміщені в бік більш електронегативного атома, називається ковалентним полярним.
Відомо, що органічних речовин є понад 20 млн. До складу їх молекул входять атоми неметалічних елементів — Карбону, Гідрогену, Оксигену, Нітрогену та деяких інших. Хімічний зв'язок між атомами цих речовин — ковалентний (є винятки). Тож сполук із ковалентним хімічним зв'язком найбільше.
Стисло про основне
• Зв'язок між атомами за допомогою спільних електронних пар називається ковалентним зв'язком.
• Ковалентний зв'язок у неорганічних й органічних речовинах виникає в результаті утворення спільних електронних пар із неспарених електронів двох атомів.
• Електронна пара при утворенні ковалентного хімічного зв'язку належить одночасно обом атомам.
• Розрізняють неполярний ковалентний зв'язок (спільні електронні пари рівновіддалені від ядер обох атомів) і полярний ковалентний зв'язок (спільні електронні пари зміщені до більш електронегативного атома).
Сторінка ерудита
Метан — летка сполука Карбону з Гідрогеном, що є основною складовою природного газу, має формулу СН4. У ній Карбон чотиривалентний. Згідно з електронною природою хімічних зв'язків, щоб утворити 4 ковалентні зв'язки, атом Карбону повинен мати 4 неспарені електрони, а не 2, як це видно з його графічної електронної формули.

Скористайтесь інформацією про збуджений стан атома Карбону, що міститься на с. 83-84, і вам стане зрозуміло, звідки з'явилися 4 неспарені електрони.
Хімічний елемент характеризують, вказуючи його місце в періодичній системі, будову атома, тип елемента, характер оксиду й гідроксиду, можлива валентність, дають порівняльну характеристику.
За місцем у періодичній системі можна охарактеризувати будь-який хімічний елемент і одержати про нього такі дані:
За положенням елемента в періодичній системі можна визначити будову його атома, родину елемента і його валентність, властивості простої речовини цього елемента та його сполук.
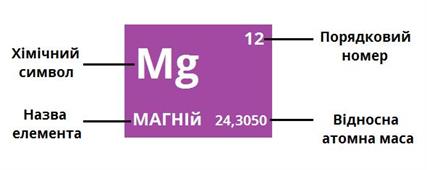
Користуючись періодичною системою елементів, дамо характеристику металічного елемента Кальцію.
Порядковий номер, заряд ядра, Аr | 20, +20, Аr =40 |
Місце в ПС | Кальцій розміщений у 4-му періоді, II групі, головній підгрупі |
Будова атома | Електронна оболонка складається з чотирьох шарів (4-й період), що містять 20 електронів. На зовнішньому енергетичному рівні знаходиться 2 електрони (номер групи). Електронна схема атома: |
Тип елемента, активність | На зовнішньому енергетичному рівні атома Кальцію міститься 2 електрони, отже це металічний елемент, хімічно активний. Валентність його – II |
Летка сполука з Гідрогеном | Леткої сполуки з Гідрогеном Кальцій не утворює |
Формула вищого оксиду, його характер | Його вищий оксид CaO має оснóвні властивості: |
Гідроксид, що йому відповідає, його характер | Йому відповідає гідроксид Ca(OH)2 |
Порівняння з властивостями елементів, що стоять поряд в періоді та підгрупі: | Знаючи, як змінюються властивості елементів в межах груп і періодів, можемо порівняти Кальцій з елементами, що його оточують. Оскільки у атома Кальцію більший заряд ядра, ніж у Калію і менший, ніж у Скандію, то металічні властивості Кальцію слабкіші ніж Калію і сильніші ніж Скандію: K > Ca > Sc. Оскільки радіус атома Кальцію більший, ніж Магнію і менший ніж Стронцію, то металічні властивості у Кальцію сильніші ніж у Магнію, але слабкіші, ніж у Стронцію: Mg < Ca < Sr |
Характеристику неметалічного елемента розглянемо на прикладі Нітрогену
Порядковий номер елемента, його назва та відносна атомна маса: | № 7, Нітроген, Ar(N) = 14 |
№ періоду, ряду, групи, підгрупи: | 2 період, 2 ряд, V група, головна підгрупа |
Заряд ядра (кількість протонів), кількість нейтронів і електронів: | 7. ē = 7, p+ = 7, n0 = 7 |
Електронна формула: | 1s22s22p3 |
Електронна конфігурація атома: | |
Валентність: | ІІІ |
Активність: | Неметалічний елемент, малоактивний |
Летка сполука з Гідрогеном: | NH3 |
Формула вищого оксиду, його характер: | N2O5 (кислотний) |
Гідратна сполука, що йому відповідає: | HNO3 (кислота) |
Порівняння з властивостями елементів, що стоять поряд в періоді та підгрупі: | Неметалічні властивості сильніше виражені ніж у Карбону та Фосфору, але слабкіше ніж у Оксигену |

• вища валентність елементів за Оксигеном зростає від
• валентність неметалічних елементів в летких сполуках з Гідрогеном зменшується від
• властивості вищих оксидів і гідроксидів поступово змінюються від основних через амфотерні до кислотних.
Розглянемо залежність властивостей елементів від їх положення в періодичній системі. Властивості елементів залежать від числа валентних електронів, що дорівнює номеру групи в періодичній таблиці.
Елементи, що мають завершені зовнішні енергетичні рівні та містять вісім електронів, є найбільш стійкими. Саме цим пояснюється хімічна інертність гелію, неону і аргону: вони взагалі не вступають у хімічні реакції. Атоми всіх інших хімічних елементів прагнуть віддати або приєднати електрони, щоб їхня електронна оболонка виявилася стійкою, при цьому вони перетворюються в заряджені частинки.
Наприклад, лужний метал Натрій — елемент головної підгрупи I групи. Висока хімічна активність натрію пояснюється наявністю в його атомах єдиного валентного електрона. Втрачаючи цей електрон, атом Натрію перетворюється на позитивно заряджений йон Na+ з електронною конфігурацією інертного газу Неону. Йони Na+ хімічно інертні. Чим більше число електронів міститься на зовнішньому електронному шарі, тим складніше їх віддавати, тому із збільшенням числа електронів на зовнішньому рівні (в періодах) металічні властивості елементів зменшуються. Хімічні елементи, які виявляють металічні властивості, як правило, мають на зовнішньому рівні від одного до трьох електронів.
В атомах галогенів, що утворюють головну підгрупу VII групи, сім електронів на зовнішньому рівні. До його завершення їм бракує тільки одного електрона, тому для них найбільш характерний процес приєднання електрона. Атом Хлору, наприклад, приєднуючи один електрон, перетворюється на йон Сl–, що має електронну конфігурацію інертного газу і є хімічно стійким. Атоми інших неметалічних елементів, подібно до атомів галогенів, прагнуть завершити зовнішній енергетичний рівень шляхом приєднання електронів. Чим більше електронів бракує до завершення електронного шару, тим важче їх приєднувати, отже, чим менше електронів на зовнішньому рівні, тим слабше виявлені неметалічні властивості. Хімічні елементи, які виявляють неметалічні властивості, як правило, мають на зовнішньому рівні від чотирьох до восьми електронів.
Таким чином, металічні властивості обумовлюються здатністю віддавати електрони, а неметалічні — здатністю їх приєднувати. Відповідно змінюються і властивості простих речовин утворених цими елементами.
Металічні властивості тим більші та, відповідно, неметалічні властивості тим менші, чим легше віддається електрон із зовнішнього енергетичного рівня. Віддати електрон із зовнішнього енергетичного рівня тим легше, чим більший атомний радіус, завдяки тому, що сила притягання ядра та електронів зменшується зі зростанням відстані між ними. Отже, зміна металічних властивостей хімічних елементів буде аналогічна зміні їх атомних радіусів. Тому в головних підгрупах металічні властивості зі збільшенням порядкового номера збільшуються, а в періодах зі збільшенням порядкового номера металічні властивості зменшуються. Неметалічні властивості, навпаки, в головних підгрупах зі збільшенням порядкового номера зменшуються, а в періодах зі збільшенням порядкового номера збільшуються.
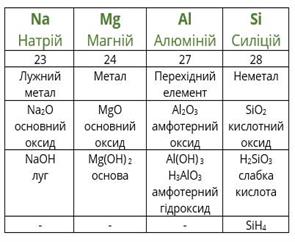
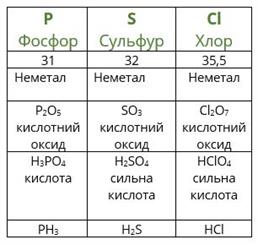
Наприклад, розташуємо хімічні елементи Al, S, Mg, Cl, Na в порядку збільшення неметалічних властивостей. Наведені хімічні елементи знаходяться у третьому періоді. У періодах неметалічні властивості зі збільшенням порядкового номера збільшуються. Отже, зазначені хімічні елементи треба записати в порядку збільшення їх порядкових номерів: Na, Mg, Al, S, Cl.Розглянемо взаємозв’язок між положенням хімічних елементів у перiодичній системі та властивостями оксидів і відповідних гідроксидів, які утворюють ці хімічні елементи, на прикладі елементів третього періоду. До третього періоду належать хімічні елементи: Na, Mg, Al, Si, P, S, Cl, Ar. Ці елементи утворюють вищі оксиди такого складу (інертний хімічний елемент Аргон оксиду не утворює): ![]() ,
, ![]() .Натрій оксид і магній оксид виявляють властивості основних оксидів, алюміній оксид є амфотерним оксидом, усі інші оксиди (силіцій(IV) оксид, фосфор(V) оксид, сульфур(VI) оксид, хлор(VII) оксид) виявляють властивості кислотних оксидів. Крім того, в ряді основні властивості послаблюються, а в ряді–
.Натрій оксид і магній оксид виявляють властивості основних оксидів, алюміній оксид є амфотерним оксидом, усі інші оксиди (силіцій(IV) оксид, фосфор(V) оксид, сульфур(VI) оксид, хлор(VII) оксид) виявляють властивості кислотних оксидів. Крім того, в ряді основні властивості послаблюються, а в ряді– ![]() –
– ![]() кислотні властивості посилюються.Так само можна проаналізувати характер зміни в періоді властивостей гідроксидів, які відповідають вищим оксидам:
кислотні властивості посилюються.Так само можна проаналізувати характер зміни в періоді властивостей гідроксидів, які відповідають вищим оксидам: ![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() .Натрій гідроксид і магній гідроксид виявляють властивості основ, алюміній гідроксид є амфотерним гідроксидом, усі інші гідроксиди виявляють властивості кислот: силікатна кислота, ортофосфатна кислота, сульфатна кислота, хлоратна кислота. Крім того, в ряді
.Натрій гідроксид і магній гідроксид виявляють властивості основ, алюміній гідроксид є амфотерним гідроксидом, усі інші гідроксиди виявляють властивості кислот: силікатна кислота, ортофосфатна кислота, сульфатна кислота, хлоратна кислота. Крім того, в ряді ![]() –
– ![]() основні властивості послаблюються, а в ряді
основні властивості послаблюються, а в ряді ![]() –
– ![]() –
– ![]() –
– ![]() кислотні властивості посилюються.Отже, в ряді елементів певного періоду послаблюються властивості основних оксидів та відповідних їм гідроксидів, а кислотні властивості в тому самому напрямку посилюються. Перехід від основних до кислотних оксидів, та, відповідно, від основ до кислот здійснюється в періоді через амфотерний оксид або гідроксид. Така закономірність є справедливою для другого та третього періодів періодичної системи. Для елементів великих періодів спостерігаються складніші закономірності.При переході від одного періоду до іншого конфігурація зовнішнього електронного шару періодично повторюється, при цьому повторюються і властивості хімічних елементів, їх простих речовин та їх сполук. Це і є головним поясненням сенсу періодичного закону Д. І. Менделєєва
кислотні властивості посилюються.Отже, в ряді елементів певного періоду послаблюються властивості основних оксидів та відповідних їм гідроксидів, а кислотні властивості в тому самому напрямку посилюються. Перехід від основних до кислотних оксидів, та, відповідно, від основ до кислот здійснюється в періоді через амфотерний оксид або гідроксид. Така закономірність є справедливою для другого та третього періодів періодичної системи. Для елементів великих періодів спостерігаються складніші закономірності.При переході від одного періоду до іншого конфігурація зовнішнього електронного шару періодично повторюється, при цьому повторюються і властивості хімічних елементів, їх простих речовин та їх сполук. Це і є головним поясненням сенсу періодичного закону Д. І. Менделєєва
Д.З. Вивчити п. 6,7,10.
Стан електронів у атомі описують, використовуючи певні математичні моделі1. Частину простору в атомі, де перебування електрона є найбільш імовірним, називають електронною орбіталлю. Орбіталь, зайнята електроном, нагадує хмару. У ній розподілені маса і заряд електрона (пригадайте, як заряджений електрон; якою є маса електрона порівняно з протоном і нейтроном). Густина електронної хмари на різній відстані від ядра різна (рис. 8.1). Рух електрона навколо власної осі має назву спін (рис. 8.2).
1 Математична модель - наближений опис об’єкта моделювання за допомогою математичної символіки.

Рис. 8.1. 1. 1s-Орбіталь. 2. Кульбаба дещо нагадує модель 1s-орбіталі

Рис. 8.2. Схематичне зображення двох електронів з протилежними спінами
На одній орбіталі одночасно може перебувати не більше двох електронів з протилежними спінами (рис. 8.2). Електронні орбіталі розрізняють за розміром і формою. Орбіталі кулястої форми позначають літерою s. Електрони, орбіталі яких мають кулясту форму, називають s-електронами (рис. 8.3). Орбіталі гантелеподібної форми позначають літерою р. Електрони, орбіталі яких мають гантелеподібну форму, називають р-електронами. р-Орбіталі розміщуються у просторі вздовж трьох взаємно перпендикулярних осей координат (рис. 8.4).

Рис. 8.3. Розміщення у просторі 1s-орбіталі

Рис. 8.4. Взаємне розташування р-орбіталей у просторі
Енергетичні рівні та підрівні. Електронні хмари різних форм до того ж відрізняються силою притягання до ядра, а самі електрони розташовані навколо ядра шарами. Енергія електрона є його найважливішою характеристикою. Електрони, які розташовані в атомі в орбіталях однакової форми і розміру, мають однакову енергію.
З урахуванням енергій електронів їх розподіляють за певними енергетичними рівнями. Максимальну кількість електронів Nmax на енергетичному рівні обчислюють за формулою: Nmax(e-) = 2n2, де n - номер енергетичного рівня.
Умовний запис будови електронних оболонок атомів називають електронною формулою. Графічний варіант електронної формули дає уявлення про кількість спарених і неспарених електронів в атомі хімічного елемента.

В атомі Гідрогену один неспарений електрон. А в атомі Гелію в s-орбіталі перебуває два спарених s-електрони з протилежними (це позначено напрямками стрілок) спінами. Енергетичний рівень в атомі Гелію завершений.

В атомі Літію три електрони. Оскільки перший рівень уміщує лише два електрони, третій електрон займе s-орбіталь другого енергетичного рівня.

Четвертий електрон атома Берилію також розміститься в s-орбіталі другого енергетичного рівня.

В атомі Бору п’ятий електрон займе р-орбіталь другого енергетичного рівня.

Електрони заповнюють орбіталі спочатку по одному. Тому шостий електрон в атомі Карбону займе наступну 2р-орбіталь.

За тим самим правилом відбудеться розміщення сьомого електрона в атомі Нітрогену.

В атомі Оксигену на другому рівні немає вільних р-орбіталей. Тому восьмий електрон складе пару одному з р-електронів.

Аналогічно відбудеться розміщення дев’ятого електрона в атомі Флуору.

В атомі Неону завершується заповнення електронами другого енергетичного рівня.

З Натрію починається заповнення електронами третього енергетичного рівня.
• Складіть електронні формули та їхні графічні варіанти для решти атомів хімічних елементів третього періоду. Порівняйте будову зовнішнього енергетичного рівня атомів елементів, які належать до однієї підгрупи.
Зверніть увагу! Електрони спочатку заповнюють орбіталі з нижчою енергією. Енергія 3-d підрівня вища за енергію 4-s підрівня (рис. 8.5). Тому в атомах Калію і Кальцію заповнюється 4-s підрівень, а 3-d підрівень залишається незаповненим. Тобто в атома Калію буде на один s-електрон більше, ніж в атома інертного елемента Аргону. Тому скорочено електронну формулу Калію записують так: [Ar]4s1.

Рис. 8.5. Порівняння енергії електронів, розміщених на певних енергетичних підрівнях

Рис. 8.6. Електронна формула
• Запишіть скорочено електронну формулу атома Кальцію.
Радіус атома характеризує його розміри. Хоча через особливу природу електрона атоми не мають чітко визначених меж, їхню форму прийнято вважати кулястою. Радіус атома - це відстань від центра його ядра до сферичної поверхні, на якій найчастіше трапляються електрони зовнішнього енергетичного рівня (рис. 8.7).

Рис. 8.7. Залежність радіуса атома від протонного числа хімічного елемента
Що більше електронних оболонок має атом, то, вочевидь, його радіус більший. У періодах зі зростанням протонного числа радіус атомів зменшується. Це зумовлено збільшенням величини заряду ядра та кількості електронів на зовнішньому енергетичному рівні - зростає сила притягання між ядром і електронами зовнішнього енергетичного рівня. У головних підгрупах зі зростанням протонного числа радіус атомів зростає.
ПРО ГОЛОВНЕ
• Електронна орбіталь - частина простору в атомі, де перебування електрона є найбільш імовірним.
• Спін - рух електрона навколо власної осі. На одній орбіталі одночасно може перебувати не більше ніж два електрони із протилежними спінами.
• Електрони, орбіталі яких мають кулясту форму, називають s-електронами.
• Електрони, орбіталі яких мають гантелеподібну форму, називають р-електронами.
• р-Орбіталі розміщуються у просторі вздовж трьох взаємно перпендикулярних осей координат.
• Максимальну кількість електронів на енергетичному рівні обчислюють за формулою: Nmax(e-) = 2n2, де n - номер енергетичного рівня.
• Умовний запис будови електронних оболонок атомів називають електронною формулою.
• Графічний варіант електронної формули дає уявлення про кількість спарених і неспарених електронів в атомі хімічного елемента.
• Радіус атома - це відстань від центра його ядра до сферичної поверхні, на якій найчастіше трапляються електрони зовнішнього енергетичного рівня.
• У періодах зі зростанням протонного числа радіус атомів зменшується. У головних підгрупах зі зростанням протонного числа радіус атомів зростає.
Перевірте себе
1. Що називають електронною орбіталлю? Спіном електрона? 2. Скільки електронів одночасно може перебувати на одній орбіталі? Якими мають бути їхні спіни? 3. Як називають електрони, орбіталі яких мають кулясту форму? 4. Орбіталі яких електронів мають гантелеподібну форму й розміщуються у просторі вздовж трьох взаємно перпендикулярних осей координат? 5. За якою формулою обчислюють максимальну кількість електронів на енергетичному рівні? 6. Що таке електронна формула атома хімічного елемента? 7. Про що дає уявлення графічний варіант електронної формули атома хімічного елемента? 8. Що називають радіусом атома? 9. Як змінюються радіуси атомів у періодах і групах періодичної системи?
Застосуйте свої знання й уміння. Д.З. Опрацюйте матеріал підручника п.5,6,7, відеоматеріали, матеріали сайту.
1. Обчисліть максимальну кількість електронів на третьому енергетичному рівні.
2. Запишіть електронну формулу атома Алюмінію.
3. Запишіть графічний варіант електронної формули атома Нітрогену й визначте число неспарених електронів у ньому.
4. Визначте хімічний елемент, атому якого відповідає електронна формула ...3s23p2.
5. Виберіть правильний запис електронної формули атома Фосфору:

6. Виберіть записи, у яких символи хімічних елементів розміщені за збільшенням радіусів їхніх атомів:
- 1) Li, В, С, F
- 2) В, N, С, F
- 3) Cl, S, Se, Те
- 4) Н, Na, Cs, К
- 5) Н, Сl, Вr, I
Творча майстерня
Змоделюйте, використовуючи повітряні кульки, s- і р-електронні хмари та їхнє взаєморозташування у просторі.
Дізнайтеся більше про стан електронів у атомі:
https://www.youtube.com/watch?v=U6Oq4EBghIM
https://www.youtube.com/watch?v=PJ8k3nQRzgQ
http://www.ptable.com/?lang=ru#Orbital
Крім обертання навколо ядра, електрон має ще свій власний рух – спін. Це рух електрона навколо своєї осі. Якщо два електрони мають однакові напрямки обертання, то говорять, що це електрони з паралельними спінами, а якщо напрямки обертання у них протилежні (один електрон обертається навколо своєї осі за годинниковою стрілкою, а інший – проти годинникової стрілки), то це – електрони з протилежними (антипаралельними) спінами. Два електрони з протилежними спінами створюють навколо себе магнітне поле з протилежно спрямованими силовими лініями, що забезпечує взаємне притягання електронів. На одній орбіталі можуть перебувати лише два електрони з протилежними спінами. Схематично атомну орбіталь позначають квадратиком, а електрони стрілочками в двох протилежних напрямках .
Характеристика орбіталей
Електронна хмара може мати різну густину, розмір і форму. Чим сильніше притягується електрон до ядра, тим його хмара щільніша і менша за розміром. Електронна хмара може мати кілька форм. Електрон рухаючись навколо ядра, може утворювати хмару кулястої форми. Орбіталь, що має форму кулі називають s-орбіталлю, а електрон, що утворює таку форму орбіталі – s-електроном.
Орбіталі можуть мати форму гантелі (об’ємної вісімки) або ще складнішу. Орбіталі, що мають форму гантелі позначають буквою p, а електрони, які утворюють таку орбіталь називають p-електронами. Ці електрони розміщуються в просторі уздовж трьох взаємно перпендикулярних осей координат.
Будова електронних оболонок атомів
На кожному енергетичному рівні рухаються електрони з однаковою чи дуже близькою енергією. Першому рівню належать електрони, які перебувають найближче до ядра і тому мають найменшу енергію. Електрони другого рівня характеризуються вищою енергією, третього — ще вищою.
Енергетичні рівні позначають буквами K, L, M, N … або цифрами 1, 2, 3, 4 … і умовно позначають їх дужками (як частиною від кола) під час запису розміщення електронів на енергетичних рівнях.
На кожному енергетичному рівні рухається обмежене число електронів. Їх максимальне число на енергетичному рівні визначається за формулою:
N = 2n2, де n — номер рівня.
I рівень 2 × 12 = 2. III рівень 2 × 32 = 18.
II рівень 2 × 22 = 8. IV рівень 2 × 42 = 32.
Схема 1. Розміщення електронів на енергетичних рівнях і підрівнях.
Якщо на орбіталі перебуває один електрон, то він називається неспареним, якщо два, то це – спарені електрони (орбіталь умовно позначають квадратиком, а електрони – стрілками в протилежних напрямках).
| | Якщо зовнішній електронний шар атома має максимальне число електронів, яке він може вмістити, то такий шар називають завершеним. Якщо в зовнішньому електронному шарі атома міститься менше електронів, ніж він може вмістити, то цей шар називають незавершеним. |
На останньому енергетичному рівні будь-якого атома не може бути більше 8 електронів.
Електронна будова атома Сульфуру
Електронна схема – це розподіл електронів в атомі на енергетичних рівнях.
Для написання електронної схеми необхідно:
1. | За порядковим номером елемента визначаємо число протонів у ядрі, і число електронів, вказуємо символ елемента. | |
2. | Номер періода вказує на число енергетичних рівнів (пишемо число дужок). | |
3. | Номер групи елемента вказує на число електронів на зовнішньому енергетичному рівні. | |
4. | Пишемо максимальне число електронів, на першому енергетичному рівні (2), а другий розраховуємо за різницею: 16 – 6 – 2 = 8. (Якщо рівнів більше, то чинимо так: пишемо число електронів за номером групи під останнім рівнем, під першими рівнями — максимальну їх кількість для цих рівнів, а під передостаннім — залишок). | |
Електронна формула — це розподіл електронів в атомі на енергетичних рівнях і підрівнях.
1. | 16 електронів у атомі Сульфуру знаходяться на трьох енергетичних рівнях. На першому рівні (1) рухається два s-електрони (число електронів пишеться вгорі справа). | 1s2 |
2. | На другому енергетичному рівні (2) рухаються два s-електрони і шість p-електронів (номер рівня пишеться для кожного підрівня). | 2s2 2p6 |
3. | На третьому енергетичному рівні (3) рухаються два s-електрони і чотири p-електрони. | 3s2 3p4 |
4. | Сумарна електронна формула матиме вигляд: | 1s22s22p63s23p4 |
Електронна конфігурація — це графічне зображення розподілу електронів на енергетичних рівнях і підрівнях. Електрони позначаються стрілочками, а орбіталі — клітинками. Вільна клітинка — це вільна орбіталь, яку може зайняти електрон після збудження.
Орбіталі заповнюють так:
1. | Перший енергетичний рівень має тільки один s–підрівень, на якому знаходяться два електрони з протилежними спінами. | |
2. | Другий енергетичний рівень має два підрівні: на s-підрівні знаходиться 2 електрони і на p-підрівні — 6 (на трьох орбіталях). | |
3. | Третій енергетичний рівень має три підрівні: на s-підрівні знаходиться 2 електрони, на p-підрівні — 4 (на трьох орбіталях), а d-підрівень (п’ять орбіталей) у Сульфуру не заповнений. | |
В такому, незбудженому, стані атом Сульфуру має два неспарені електрони – тобто проявляє валентність II.
На третьому d-підрівні є вільні орбіталі, тому в збудженому стані електрони з 3p-підрівня та 3s-підрівня можуть «перестрибувати» на 3d-підрівень, займаючи вільні орбіталі. Валентність атома при цьому змінюється на ІV або VІ.
** Запишіть електронні формули атомів: Li, Na, Al, S, Si, їх валентність у збудженому і незбудженому станах.
** 67. Зазначте кількість електронів, яка міститься на зовнішньому енергетичному рівні в атомі елемента з протонним числом 13: а) 5; б) 1; в) 2; г) 3.
** Оксид хімічного елемента I групи головної підгрупи має відносну молекулярну масу 232. Назвіть цей елемент.
Розташувавши всі відомі хімічні елементи в порядку зростання атомних мас, Менделєєв виявив, що властивості повторюються через певне число елементів.
Повторимо дії Менделєєва з урахуванням того факту, що благородні гази на той час ще не були відомі. Розташуємо елементи за зростанням атомної маси (другий рядок таблиці), вкажемо металічні та неметалічні властивості, формули і властивості вищих оксидів і гідроксидів, а також формули газоподібних сполук з Гідрогеном.
• вища валентність елементів за Оксигеном зростає від
• валентність неметалічних елементів в летких сполуках з Гідрогеном зменшується від
• властивості вищих оксидів і гідроксидів поступово змінюються від основних через амфотерні до кислотних.
У 60-х рр. XIX століття було відомо 63 хімічні елементи. До їх числа входили такі відомі здавна елементи, як Аурум, Арґентум, Оксиген, Гідроген, Сульфур та інші. Перші спроби класифікації хімічних елементів були засновані на різко виражених протилежних властивостях простих речовин, утворених хімічними елементами, – металів і неметалів.
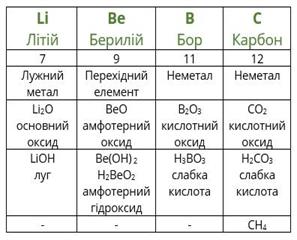
Пізніше було з’ясовано, що існують групи споріднених за властивостями елементів, які було названо природними групами (або сімействами). Наприклад, в одну з природних груп були об’єднані такі хімічні елементи, як Li, Na та K, а пізніше ще й Rb та Cs. Ці хімічні елементи утворюють прості речовини – метали, які є м’якими, пластичними, мають металічний блиск, дуже добре проводять тепло та електричний струм. Ці метали у порівнянні з усіма іншими металами відрізняються найбільшою хімічною активністю. Оксиди цих металів (Li2O, Na2O, K2O, Rb2O, Cs2O) виявляють яскраво виражені основні властивості. Цим оксидам відповідають розчинні у воді основи – луги (LiOH, NaOH, KOH, RbOH, CsOH). У своїх сполуках ці елементи проявляють валентність І. Ці метали, об’єднані в одну природну групу, отримали назву лужних металів.
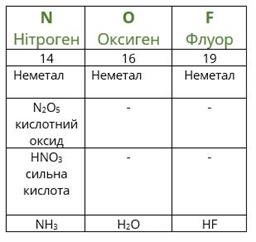
В іншу природну групу, споріднених за властивостями елементів, було включено Cl, Br, I, а пізніше F. Ці хімічні елементи утворюють прості речовини – неметали. За звичайних умов прості речовини фтор та хлор є газами, бром – рідиною, йод – кристалічною речовиною. Ці неметали порівняно з усіма іншими неметалами відрізняються найбільшою хімічною активністю. При взаємодії з металами вони утворюють солі (NaCl, MgBr2, KI). Ці неметали, об’єднані в одну природну групу, здобули назву галогенів, що з грецької перекладається як «ті, що народжують солі».
Крім лужних металів і галогенів, відома група інертних елементів, які у вигляді простих речовин утворюють благородні гази. До цієї групи належать хімічні елементи He, Ne, Ar, Kr, Xe, Rn. Молекули їх простих речовин є одноатомними. Всі вони за звичайних умов є газами, що в невеликих кількостях містяться в повітрі. Інертні елементи майже не утворюють хімічних сполук з іншими елементами, про що говорить їх назва.
Виокремлення природних груп подібних за властивостями елементів було важливим етапом класифікації елементів. Проте це не вирішувало головного завдання – створення класифікації всіх елементів, як схожих, так і несхожих за властивостями. До кінця 60-х рр. XIX століття було зроблено більше 50 спроб класифікації хімічних елементів. Найближче до відкриття періодичного закону підійшов Л. Мейєр. Він опублікував у 1864 році таблицю, в якій розмістив 44 із 63 відомих елементів у шести групах відповідно до зростання атомних мас за їх вищою валентністю за Гідрогеном, а в 1868 році опублікував напівдовгу таблицю елементів, у якій уперше вказав періоди. Головним недоліком робіт Л. Мейєра була відсутність наукової основи класифікації елементів.
Приміром, Флуор, Хлор, Бром, Йод, які належать до природної родини галогенів (Hal), утворюють однотипні речовини складу Наl2, де Hal - це F, Cl, Br, I тощо (рис. 4.1). Гідроген галогеніди (галогеноводні) - речовини із загальною формулою ННаl (рис. 4.2) - за звичайних умов - їдкі задушливі гази, добре розчинні у воді. Їхні водні розчини - кислоти.

Так само подібні між собою лужні елементи - Літій, Натрій, Калій тощо. Усі лужні метали - прості речовини лужних елементів - м’які (їх легко розрізати ножем), із характерним металічним блиском (рис. 4.3).

1. Лужні метали - літій, натрій, калій. Їх зберігають під шаром гасу через швидке окиснення киснем повітря. 2. Натрій легко розрізати ножем.
Лужні метали активно реагують з водою. Унаслідок реакцій утворюється луг і виділяється водень: Na + Н2О → NaOH + H2↑. Його реактивна сила в момент виділення зумовлює рух шматочка лужного металу поверхнею води.

Реакція натрію з водою, до якої добавлено індикатор фенолфталеїн.
Завдання. Поміркуйте, чому фенолфталеїн набуває малинового кольору в розчині, що утворюється внаслідок реакції натрію з водою. Перетворіть схему реакції натрію з водою на хімічне рівняння
Загальна формула сполуки лужного елемента з галогеном - ЕНаl. Ці речовини кристалічні (рис. 4.5). Найвідоміша з них - натрій хлорид - кухонна сіль.

Натрій хлорид NaCl (1) і калій бромід КВr (2) - кристалічні речовини
Природна родина інертних елементів - Гелій, Неон, Аргон, Криптон, Ксенон і Радон (рис. 4.6). Відповідні одноатомні прості речовини - інертні гази - вирізняються тим, що мають дуже низьку реакційну здатність.

1. Гелій - такий легкий... 2. Аргонове зварювання забезпечує надійність і довговічність сполучень. 3. Ксенонове світло - безпека й комфорт для водія. 4. Цілюща дія радонових вод
Та всі згадані спроби класифікації хімічних елементів були недосконалими, бо не мали єдиної основи. Тож науковий пошук тривав...
Д.З. Вивчити п.1. Знайти цікаву інформацію про хімічні елементи, їх властивості (приготувати повідомлення)
хімія — наука про речовини та їх перетворення.
Хімія вивчає склад речовин, їхню будову та властивості (здатність вступати у реакції з іншими речовинами, вплив на організм людини та довкілля), можливість використання речовин у побуті, науці, медицині, техніці тощо.
Для успішного засвоєння знань з хімії у 8 класі вам необхідно повторити найважливіші хімічні поняття, які ви вивчили раніше: речовина, атом, хімічний елемент та інші.
1. Речовина. Структурні частинки речовини. Хімічний елемент
Речовини — це все, що має певну масу і займає деякий об'єм у навколишньому просторі.
Хімія вивчає речовину, організовану в йони (частинки, з якими ви ознайомитеся у курсі хімії 8 класу), молекули, кристали тощо, тобто те, з чого складаються тіла.
• Наведіть приклади відомих вам речовин. Де вони використовуються?
Пригадайте, що
атом — це найдрібніша хімічно неподільна частинка речовини;
молекула — найдрібніша частинка речовини, що складається з атомів, сполучених між собою хімічними зв'язками;
хімічний елемент — це вид атомів з певним зарядом ядра.
• Знайдіть у періодичній системі хімічні елементи з порядковими номерами 8,13 і 20 та назвіть їх.
• Назвіть хімічні елементи, символи яких Cu, P, Si.
Оскільки маси атомів дуже малі, то на практиці використовують відносну атомну масу хімічного елемента.
Відносна атомна маса Ar показує, у скільки разів маса атома більша за 1/12 маси атома Карбону.
• Яку відносну атомну масу мають Оксиген, Сульфур, Магній?
2. Хімічна формула
Хімічна формула — це позначення атома, молекули або речовини за допомогою символів хімічних елементів та індексів.
• Пригадайте та запишіть у зошиті формулу карбонатної кислоти. Поясніть її якісний та кількісний склад.
• Напишіть формулу речовини, молекула якої складається із трьох атомів Гідрогену, одного атома Фосфору і чотирьох атомів Оксигену.
3. Класифікація речовин
На сьогодні відомо близько 60 млн речовин. Щоб орієнтуватись серед такої величезної кількості речовин, їх розподіляють на окремі класи, тобто класифікують. Найпростішим є поділ на прості і складні речовини.
Прості речовини утворені атомами одного хімічного елемента.
• Наведіть приклади простих речовин; запишіть у зошиті їхні формули і назви. Які з них належать до речовин-металів, а які — речовин-неметалів?
Складні речовини складаються з різних хімічних елементів.
• Наведіть приклади складних речовин; запишіть їхні формули і назви. укажіть серед них оксиди, основи та кислоти.
4. Валентність хімічних елементів
Валентність — здатність атома сполучатися з певною кількістю таких самих або інших атомів.
• Яку валентність у хімічних сполуках виявляють Гідроген і Оксиген?
• Визначте валентність елементів у сполуках, що мають такі формули: NH3, P2O5, SO3, H2S.
Пригадайте, що у бінарній сполуці
добуток числа атомів одного елемента на його валентність дорівнює добутку числа атомів іншого елемента на його валентність.
• Складіть формули сполук за вказаними валентностями деяких елементів:
![]()
5. Закон збереження маси речовин під час хімічної реакції
під час хімічного перетворення маса речовин залишається незмінною — загальна маса усіх вихідних речовин дорівнює загальній масі усіх продуктів реакції.
• Пригадайте, хто відкрив закон збереження маси речовин.
• Перетворіть на хімічні рівняння такі схеми реакцій:
B + O2 → B2O3
AgNO3 → Ag + NO2 + O2
NaOH + P2O5 → Na3PO4 + H2O
6. Класифікація хімічних реакцій
За кількістю реагентів і продуктів реакції класифікують на реакції розкладу, сполучення, заміщення та обміну (два останні типи реакцій вивчатимуться пізніше).
Реакціями розкладу називають реакції, під час перебігу яких із однієї речовини утворюються декілька нових речовин.
• Напишіть рівняння реакції добування кисню з гідроген пероксиду.
Реакції, під час перебігу яких із кількох речовин утворюється одна речовина, називають реакціями сполучення.
• Напишіть рівняння реакцій кисню з воднем, сіркою, залізом.
7. Взаємодія води з оксидами
Пригадайте, що
оксиди — це складні речовини, утворені двома хімічними елементами, одним із яких є Оксиген.
• Із наведеного переліку виберіть формули оксидів: MgO, HNO3, P2O5, K3PO4, CaO.
Із курсу хімії 7 класу ви знаєте, що вода взаємодіє з багатьма речовинами, у тому числі з оксидами металічних і неметалічних елементів, наприклад:
СаО + Н2О = Са(ОН)2
Na2O + H2O = 2NaOH
P2O5 + 3H2O = 2H3PO4
CO2+ H2O = H2CO3
• Назвіть оксиди, що вступають у реакцію.
Дайте назви продуктам реакції.
• До якого типу хімічних реакцій належить взаємодія води з оксидами?
Пригадайте, що NaOH і Ca(OH)2 належать до класу основ.
Основи — це складні речовини, утворені металічними елементами і гідроксильними групами -ОН.
• Як називають розчинні у воді основи?
Із курсу хімії 7 класу ви вже знаєте, що
хімія — наука про речовини та їх перетворення.
Хімія вивчає склад речовин, їхню будову та властивості (здатність вступати у реакції з іншими речовинами, вплив на організм людини та довкілля), можливість використання речовин у побуті, науці, медицині, техніці тощо.
Для успішного засвоєння знань з хімії у 8 класі вам необхідно повторити найважливіші хімічні поняття, які ви вивчили раніше: речовина, атом, хімічний елемент та інші.
1. Речовина. Структурні частинки речовини. Хімічний елемент
Речовини — це все, що має певну масу і займає деякий об'єм у навколишньому просторі.
Хімія вивчає речовину, організовану в йони (частинки, з якими ви ознайомитеся у курсі хімії 8 класу), молекули, кристали тощо, тобто те, з чого складаються тіла.
• Наведіть приклади відомих вам речовин. Де вони використовуються?
Пригадайте, що
атом — це найдрібніша хімічно неподільна частинка речовини;
молекула — найдрібніша частинка речовини, що складається з атомів, сполучених між собою хімічними зв'язками;
хімічний елемент — це вид атомів з певним зарядом ядра.
• Знайдіть у періодичній системі хімічні елементи з порядковими номерами 8,13 і 20 та назвіть їх.
• Назвіть хімічні елементи, символи яких Cu, P, Si.
Оскільки маси атомів дуже малі, то на практиці використовують відносну атомну масу хімічного елемента.
Відносна атомна маса Ar показує, у скільки разів маса атома більша за 1/12 маси атома Карбону.
• Яку відносну атомну масу мають Оксиген, Сульфур, Магній?
2. Хімічна формула
Хімічна формула — це позначення атома, молекули або речовини за допомогою символів хімічних елементів та індексів.
• Пригадайте та запишіть у зошиті формулу карбонатної кислоти. Поясніть її якісний та кількісний склад.
• Напишіть формулу речовини, молекула якої складається із трьох атомів Гідрогену, одного атома Фосфору і чотирьох атомів Оксигену.
3. Класифікація речовин
На сьогодні відомо близько 60 млн речовин. Щоб орієнтуватись серед такої величезної кількості речовин, їх розподіляють на окремі класи, тобто класифікують. Найпростішим є поділ на прості і складні речовини.
Прості речовини утворені атомами одного хімічного елемента.
• Наведіть приклади простих речовин; запишіть у зошиті їхні формули і назви. Які з них належать до речовин-металів, а які — речовин-неметалів?
Складні речовини складаються з різних хімічних елементів.
• Наведіть приклади складних речовин; запишіть їхні формули і назви. укажіть серед них оксиди, основи та кислоти.
4. Валентність хімічних елементів
Валентність — здатність атома сполучатися з певною кількістю таких самих або інших атомів.
• Яку валентність у хімічних сполуках виявляють Гідроген і Оксиген?
• Визначте валентність елементів у сполуках, що мають такі формули: NH3, P2O5, SO3, H2S.
Пригадайте, що у бінарній сполуці
добуток числа атомів одного елемента на його валентність дорівнює добутку числа атомів іншого елемента на його валентність.
• Складіть формули сполук за вказаними валентностями деяких елементів:
![]()
5. Закон збереження маси речовин під час хімічної реакції
під час хімічного перетворення маса речовин залишається незмінною — загальна маса усіх вихідних речовин дорівнює загальній масі усіх продуктів реакції.
• Пригадайте, хто відкрив закон збереження маси речовин.
• Перетворіть на хімічні рівняння такі схеми реакцій:
B + O2 → B2O3
AgNO3 → Ag + NO2 + O2
NaOH + P2O5 → Na3PO4 + H2O
6. Класифікація хімічних реакцій
За кількістю реагентів і продуктів реакції класифікують на реакції розкладу, сполучення, заміщення та обміну (два останні типи реакцій вивчатимуться пізніше).
Реакціями розкладу називають реакції, під час перебігу яких із однієї речовини утворюються декілька нових речовин.
• Напишіть рівняння реакції добування кисню з гідроген пероксиду.
Реакції, під час перебігу яких із кількох речовин утворюється одна речовина, називають реакціями сполучення.
• Напишіть рівняння реакцій кисню з воднем, сіркою, залізом.
7. Взаємодія води з оксидами
Пригадайте, що
оксиди — це складні речовини, утворені двома хімічними елементами, одним із яких є Оксиген.
• Із наведеного переліку виберіть формули оксидів: MgO, HNO3, P2O5, K3PO4, CaO.
Із курсу хімії 7 класу ви знаєте, що вода взаємодіє з багатьма речовинами, у тому числі з оксидами металічних і неметалічних елементів, наприклад:
СаО + Н2О = Са(ОН)2
Na2O + H2O = 2NaOH
P2O5 + 3H2O = 2H3PO4
CO2+ H2O = H2CO3
• Назвіть оксиди, що вступають у реакцію.
Дайте назви продуктам реакції.
• До якого типу хімічних реакцій належить взаємодія води з оксидами?
Пригадайте, що NaOH і Ca(OH)2 належать до класу основ.
Основи — це складні речовини, утворені металічними елементами і гідроксильними групами -ОН.
Д.З. Повторіть основні поняття хімії. Виконайте завдання по рівням ( вибрать на власний розсуд)
Середній рівень
8. Напишіть формули речовин, які читаються так: кальцій-о, натрій-о-аш, аш-три-пе-о-чотири.
9. Із наведеного переліку випишіть окремо формули простих і складних речовин; прості речовини класифікуйте на метали і неметали: Cu, Ca(OH)2, Al, S, H3PO4, H2, CO2, P, Mg.
10. Які реакції називають реакціями розкладу? (Усно).
11. Які реакції називають реакціями сполучення? (Усно).
12. Розташуйте хімічні сполуки за зростанням значення валентності хімічного елемента, сполученого з Оксигеном:
- А) NO2
- Б) N2O3
- В) NO
- Г) N2O
13. Складіть рівняння хімічної реакції між киснем і магнієм. Укажіть коефіцієнт біля формули продукту реакції.
- А) 1
- Б) 2
- В) 3
- Г) 4
Достатній рівень
14. Складіть формули сполук за валентністю елементів:
![]()
15. Перетворіть на хімічні рівняння такі схеми реакцій:
- N2 + H2 → NH3
- Na2SiO3 + HCl → H2SiO3 + NaCl
- Cu(NO3)2 → CuO + NO2 + O2
- C + Al2O3 → Al4C3 + CO
16. Укажіть рівняння реакції, у якому неправильно дібрані коефіцієнти:
- А) 2Н2О = 2Н2+ О2
- Б) N2 + O2 = 4NO
- В) C + O2 = CO2
- Г) 2CO + O2 = 2CO2
17. Перетворіть схему реакції FeS2 + O2 → Fe2O3 + SO2 на хімічне рівняння та вкажіть суму коефіцієнтів у його лівій частині.
- А) 7
- Б) 10
- В) 11
- Г) 15
18. Напишіть рівняння реакцій кисню із вуглецем, магнієм і міддю. До якого типу належать ці реакції?
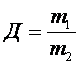
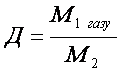
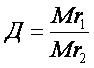
Немає коментарів:
Дописати коментар