07.05.2021
Тема: Нуклеїнові кислоти. Біологічна роль нуклеїнових кислот. Природні і синтетичні органічні речовини.
Нуклеїнові кислоти — найважливіші органічні сполуки, які зумовлюють можливість існування й розвитку всіх живих організмів. Вони відіграють головну роль у зберіганні й реалізації генетичної інформації. Нуклеїнові кислоти було відкрито в середині 60-х років ХIХ ст. швейцарським ученим Ф. Мішером. Вивчаючи склад деяких клітин, учений відкрив невідому речовину біологічного походження, що істотно відрізнялася від відомих на той час білків, жирів і вуглеводів. Він назвав цю речовину нуклеїном, оскільки виділив її з ядра клітини. Хімічний склад нуклеїнових кислот остаточно було встановлено лише наприкінці 30-х років ХХ ст., а їхній склад значно пізніше був установлений ученими Д. Вотсоном і Дж. Кріком, за що в 1953 році вони одержали Нобелівську премію.
Нуклеїнові кислоти — це біополімери, макромолекули яких складаються з багаторазово повторюваних ланок — нуклеотидів, тому їх називають також полінуклеотидами.
Розрізняють два типи нуклеїнових кислот: дезоксирибонуклеїнові кислоти (ДНК), які зберігають генетичну інформацію, і рибонуклеїнові (РНК), що беруть участь у процесах передачі генетичної інформації та біосинтезі білка в клітинах. Головна відмінність їх хімічного складу полягає в тому, що в молекулах ДНК міститься залишок вуглеводу дезоксирибози, а в молекулах РНК — рибози. Це відбивається в їхніх назвах.
Нуклеїнові кислоти — природні високомолекулярні сполуки, набагато складніші, ніж білки й полісахариди. Молекулярна маса нуклеїнових кислот коливається від 100 тисяч до 60 мільярдів. Молекули ДНК — найбільші молекули серед усіх відомих, їх довжина може досягати кількох сантиметрів, тобто в 10 мільйонів разів більше за розміри звичайних молекул. У клітинах вони багаторазово згорнуті, але якщо розгорнути молекули ДНК лише однієї клітини людини, то вони становитимуть ланцюжок кілька метрів завдовжки. Це свідчить про складність будови молекул нуклеїнових кислот, але основний принцип їх будови дуже простий. Ланцюжки нуклеїнових кислот складаються з постійно повторюваних ланок — нуклеотидів, специфічне повторення яких і зумовлює запис спадкової інформації.
Нуклеотиди — структурні ланки нуклеїнових кислот — містять три складові:
· азотисту основу — піримідинову або пуринову;
· моносахариди — рибозу або 2-дезоксирибозу;
· залишок фосфатної кислоти.
Нуклеотид — фосфатний естер нуклеозиду. До складу нуклеозиду входять два компоненти: моносахарид (рибоза або дезоксирибоза) і азотиста основа.
Будова та складові нуклеотиду
Будова та складові нуклеозиду
У молекулах ДНК наявні чотири основні типи нітрогеновмісних основ: аденін, гуанін, цитозин і тимін. До складу РНК замість тиміну входить подібний до нього за будовою урацил.
Нуклеотиди, з’єднуючись один з одним, утворюють полінуклеотидний ланцюг. Молекули РНК складаються з одного такого ланцюга, а молекули ДНК — із двох полінуклеотидних ланцюжків. Ці ланцюжки з’єднуються між собою водневим зв’язком у суворій послідовності: тимін з одного ланцюжка лише з аденіном протилежного, а цитозин — тільки з гуаніном. Об’єднавшись, два полінуклеотидні ланцюжки згортаються в спіраль, тобто молекула ДНК стає подвійною спіраллю.
 У клітинах живих істот молекули ДНК з’єднуються з особливими, ядерними, білками, багаторазово згортаються й утворюють хромосоми.
У клітинах живих істот молекули ДНК з’єднуються з особливими, ядерними, білками, багаторазово згортаються й утворюють хромосоми.
Макромолекула ДНК являє собою два паралельні нерозгалужені полінуклеотидні ланцюги, закручені навколо загальної осі в подвійну спіраль.
Така просторова структура містить безліч водневих зв’язків, утворених азотистими основами, спрямованими всередину спіралі.
Водневі зв’язки виникають між пуриновою основою одного ланцюга й піримідиновою основою іншого ланцюга. Ці основи складають комплементарні пари (від лат. complementum — «доповнення»).
Утворення водневих зв’язків між комплементарними парами основ зумовлено їхньою просторовою відповідністю. Піримідинова основа комплементарна пуриновій основі:
Водневі зв’язки між іншими парами основ не дозволяють їм розміститися в структурі подвійної спіралі. Отже,
https://www.youtube.com/watch?v=Z4ae3jz4-A4
Опрацювати п. 39. Підготуватись до практичної роботи №5 ст.192
27.04.2021-30.04.2021
Тема: Амінооцтова кислота. Білки
Амінокислоти — це нітрогеновмісні органічні речовини, у молекулах яких містяться аміногрупа -NH2 і карбоксильна група -COOH, з’єднані з вуглеводневим радикалом.
Загальна формула амінокислот — H2N - R - COOH.
За систематичною номенклатурою назви амінокислот утворюються з назв відповідних кислот шляхом додавання префікса аміно- й зазначенням місця розташування аміногрупи відносно карбоксильної групи.
https://www.youtube.com/watch?v=ZzQRlKKUZKU
Опрацювати п. 39
20.04.2021-23.04.2021
Тема: Узагальнення знань про оксигеновмісні органічні сполуки.
І рівень (по 0,5 бала)
Завдання з вибором однієї правильної відповіді
1. Вкажіть, що містять одноатомні спирти:
А один атом Карбону;
Б одну карбонільну групу;
В один атом Гідрогену;
Г одну гідроксогрупу, сполучену з вуглеводневою частиною.
2. Вкажіть формулу речовини, з якою реагує метанова кислота:
А Cu; Б Аg; В Са; Г Нg .
3. Вкажіть формулу метаналю:
А НСОН; Б СН3(СН2)2СОН;
В СН3СОН; Г СН3СН2СОН.
4. Вкажіть функціональну групу спиртів:
А карбонільна; Б гідроксильна;
В карбоксильна; Г аміногрупа.
5. Вкажіть, як одержують гліцерол:
А з рослинних і тваринних жирів;
Б під час перегонки нафти;
В під час сухої перегонки деревини;
Г із природного газу.
6. Вкажіть фізичні властивості фенолу:
А прозора рідина з характерним запахом;
Б газоподібна речовина, добре розчинна у воді;
В безбарвна кристалічна речовина з характерним запахом, отруйна;
Г безбарвна тверда речовина, без запаху, неотруйна.
ІІ рівень ( по 1 балу)
Завдання з вибором кількох правильних відповідей
7. Позначте спирти, які можуть утворити альдегіди при окисленні:
А 2-метил-1-пропанол; Б 2-метил-2-пропанол;
В 1-бутанол; Г 2-бутанол.
Завдання на встановлення відповідності
8. Встановіть відповідність між реагентами якісних реакцій та класом сполук:
А алкени 1 металічний натрій;
Б альдегіди 2 купрум (ІІ) оксид;
В одноатомні спирти 3 аргентум оксид;
Г багатоатомні спирти 4 купрум (ІІ) гідроксид;
5 бромна вода.
Завдання на встановлення послідовності
9. Встановіть послідовність використання реактивів у поданому ланцюзі перетворень:
1 2 3 4
Етан →Хлороетан → Етилен → Етанол →Діетиловий етер
А хлор; Б вода; В сульфатна кислота;
Г нітратна кислота; Д натрій гідроксид.
ІІІ рівень ( по 1,5 бала )
10. Складіть рівняння реакцій, за якими можна здійснити такі перетворення:
С2Н6 → С2Н4 → С2Н5ОН → С2Н5Вr
↓
С2Н5ОК
11. Обчисліть об’єм гідроген хлориду, який повністю прореагує з 0,4 моль етанолу.
ІV рівень (3 бали )
12. Із 2 кг технічного кальцій карбіду при взаємодії з водою можна добути 260 л ацетилену. Скільки потрібно використати технічного кальцій карбіду для одержання 44 кг ацетальдегіду, якщо вихід за реакцією Кучерова становить 80% ?
16.04.2021
Тема: Використання вуглеводів, їх біологічна роль.
Значення вуглеводів можна описати одним реченням: це речовини, без яких життя на планеті Земля не було б таким солодким.
І не лише тому,судіть самі: вуглеводи допомагають нам розв'язати безліч проблем. Вони живлять, вдягають, лікують, зігрівають, забезпечують рух, зберігають сталість внутрішнього середовища організму, беруть участь у збереженні й відтворенні спадкової інформації тощо
Глюкоза є цінним поживним продуктом. В організмі вона піддається
складним біохімічним перетворенням, у результаті яких утворюються вуглекислий газ і вода :
С6Н12О6+6О2- 6СО2 +6Н2О( при цьому виділяється 2870кдж/моль енергії)
Цей процес перебігає поступово, і тому енергія виділяється повільно.
Оскільки глюкоза легко засвоюється організмом, її використовують:
-у медицині як лікарський засіб при явищах серцевої слабкості та входить до протишокових рідин;
- широко застосовують глюкозу в кондитерській справі для виготовлення
мармеладу, карамелі, пряників тощо,
-у текстильній промисловості як відновник, як вихідний продукт при виробництві аскорбінової і гліконових кислот,
-для синтезу ряду похідних цукрів .
Велике значення мають процеси бродіння глюкози.
Так, наприклад, при квашенні капусти, огірків, молока відбувається молочнокисле бродіння глюкози, так само як і при силосуванні кормів
В даному випадку утворена молочна кислота є природнім консервантом.
Якщо ж масу, що піддається силосуванню, недостатньо ущільнити, то під впливом повітря відбувається масляно-кисле бродіння і корм стає непридатним до застосування.
На практиці часто використовується також спиртове бродіння глюкози, наприклад, при виробництві вина та пива.
Фруктоза
У рослинному світі широко поширена фруктоза або фруктовий (плодовий) цукор. Фруктоза міститься в солодких плодах, меді. Витягуючи з кольорових солодких плодів соки, бджоли готують падовий мед, який за хімічним складом являє собою в основному суміш глюкози і фруктози. Також фруктоза входить до складу складних цукрів, наприклад тростинного та бурякового. Калорійність фруктози аналогічна до глюкози і складає близько 4 ккал/г. Фруктозу ,в невеликих дозах, можна рекомендувати для харчування хворим на цукровий діабет, оскільки її засвоєння не супроводжується значним підвищенням рівня цукру у крові.
Сахароза
Сахароза застосовується:
а) як продукт харчування;
б) у кондитерській промисловості;
в) для одержання штучного меду ;
г) для приготування вин, пива.
«Здивуй мене» Цікаві факти про цукор
-У Індії ще 2000 років тому виробляли кристалічний цукор з очерету. Коли Олександр Македонський дістався до індійської території, він був здивований процесом отримання меду без використання бджіл (тобто, штучного меду з цукру).
-У 1747 році німецький хімік Андреас Маргаф виявив, що цукор в цукровому буряці ідентичний такому в цукровій тростині. Це відкриття відкрило дорогу виробництву цукру в північних регіонах – перший цукровий завод, одержуючий цукор з буряка, запрацював в 1802 році.
-Вживання зайвої кількості цукру може привести до появи зморшок через те, що цукор відкладається про запас в колаген шкіри, роблячи її менш еластичною. Хороша новина – якщо зменшити споживання цукру, то цей процес звертається назад.
-Цукор зміцнює асфальт. Також він уповільнює застигання готового бетону і клею.
-Цукор використовується при виготовленні чорнила і фарб для принтерів.
-Ви можете за один присід з’їсти 16 кубиків цукру? А знаєте, що в 500 мл кока-коли знаходиться еквівалент 16 кубиків цукру, і при її вживанні увесь цей цукор в розчиненому виді потрапляє у ваш шлунок.
-Якщо змішати глюкозу, кукурудзяний сироп і селітру, вийде один з видів ракетного палива, яке використовується любителями модельного ракетобудування.
Крохмаль
Крохмаль - рослинний полісахарид, утворюється в рослинах із глюкози і накопичується в коренях, бульбах і насінні. Він є основним вуглеводом продуктів харчування.
Так, у борошні міститься 75–80 % крохмалю, в картоплі — 25 % і т. д.
Безпосередньо він організмом не засвоюється, його енергетична цінність
складає близько 16,8 кДж/моль.
Крохмаль є цінним поживним продуктом. Щоб полегшити його засвоєння, продукти, що містять крохмаль, піддають дії високої температури, тобто картоплю варять, хліб печуть. Під дією ферментів відбувається гідроліз крохмалю, який починається вже при пережовуванні їжі в роті, триває в шлунку й кишечнику. Глюкоза, що утворюється в результаті гідролізу, усмоктується в кров і надходить у печінку, а звідти — в усі тканини організму. Надлишок глюкози відкладається в печінці у вигляді високомолекулярного вуглеводу глікогену («тваринний крохмаль»), що знову гідролізується до глюкози у міру витрати її клітинами організму.
У промисловості крохмаль шляхом гідролізу перетворюють на патоку
і глюкозу.
- Якщо гідроліз крохмалю не доводити до кінця, то утворюється
суміш декстрину з глюкозою — патока, яку застосовують у кондитерській
промисловості.
- Отримані за допомогою крохмалю декстрини використовуються як клей, для загустіння фарб при нанесенні малюнків на тканину.
- Крохмаль застосовують для накрохмалювання білизни.
- Крохмаль і його похідні також застосовуються при виробництві паперу, текстильних виробів, у ливарному та інших виробництвах, а також
у фармацевтичній промисловості.
- Великі об’єми крохмалю витрачаються на виробництво етилового спирту. У цьому процесі спочатку крохмаль піддають гідролізу під дією ферментів солоду, а продукт гідролізу — бродінню в присутності дріжджів
з утворенням спирту.
Целюлоза
- Целюлоза — основна речовина рослинних клітин: деревина складається з неї на 50 %, а бавовна і льон — це майже чиста целюлоза.
- Організм людини і багатьох інших тварин (окрім жуйних тварин і кроликів) не здатні перетравлювати целюлозу.
- Хоча крохмаль і целюлоза мають однаковий хімічний склад, завдяки різній будові молекул вони виконують різні функції в організмі: крохмаль — поживна речовина, а целюлоза — міцний будівельний матеріал.
Целюлоза використовується людиною з дуже давніх часів.
- Спочатку застосовували деревину як горючий і будівельний матеріал;
- Потім бавовняні, лляні та інші волокна почали використовувати як текстильну сировину.
- Основна галузь, у якій використовується целюлоза,— паперова. Папір
складається в основному з целюлози, яку з цією метою виділяють із деревини. Це тонкий шар волокон клітковини, спресованих і проклеєних для
створення механічної міцності та гладкої поверхні.
- Целюлозу використовують також у виробництві штучних волокон і вибу-хових речовин.
- Із майже чистої целюлози виготовляють дуже міцну плівку — целофан.
- Обробкою целюлози оцтовою кислотою добувають ацетилцелюлозу,
з якої виготовляють ацетатне волокно (штучний шовк) та кіно- і фотоплівку.
- Целюлоза використовується також для отримання скипидару, деревного
вугілля, оцтової кислоти, метану, каніфолі, смоли, глюкози, кормових дріжджів, бездимного пороху та ін.
Користь і шкода вуглеводів
Історик: Потреба в солодких речовинах завжди існувала в людській природі, і з найвіддаленіших часів жителям теплих країн були відомі рослини, що мали солодкий смак. Але першим у часі цукристим матеріалом, який вживали в їжу ще в доісторичні часи та який був предметом обміну, а потім торгівлі, був мед - продукт, який бджоли вилучають із квітів рослин.
З часом на зміну йому прийшов цукор. Історичні джерела свідчать, що виробництво кристалічного цукру із цукрової тростини виникло в Східній Індії ще в 4 ст. до н. є. До речі, сам термін «цукор» або сахар походить від індуського «саркара».
Кондитер: Цукор — незамінний продукт і за обіднім столом, і в туристському поході, і під час занять спортом. Це не тільки постійний супутник уранішнього чаю чи кави, а й важливий компонент тістечок, тортів, печива, цукерок на будь-якому святі. Задоволення від споживання цих страв зумовлено значною мірою солодким смаком цукру. Цукор є харчовим продуктом і сировиною в кондитерській, хлібопекарській, консервній, молочній та інших галузях харчової промисловості.
Фізіолог:В організмі вуглеводи виконують такі функції:
-Є основним джерелом енергії в організмі. Під час окиснення 1г глюкози виділяється 16,9 кДж (4ккал) енергії.
-Забезпечують всі енергетичні витрати мозку (мозок поглинає близько 70% глюкози, що виділяється печінкою)
-Беруть участь у синтезі молекул АТФ, ДНК і РНК.
-Регулюють обмін білків і жирів. -У комплексі з білками вони утворюють деякі ферменти і гормони, секрети слинних та інших утворюючих слиз залоз, а також інші сполуки.
-Харчові волокна покращують роботу травної системи і виводять з організму шкідливі речовини, пектини стимулюють процес травлення.
-Вуглеводи у комплексі з білками входять до складу хрящових тканин, виконуючи опорну функцію.
Лікар: Як уважають фахівці, солодкий смак за лікувальним впливом на організм людини — найсильніший, він сприяє травленню, загоюванню ран, довголіттю.
-Здатність засвоювати глюкозу притаманна всім клітинам тваринних організмів. Ця сполука - універсальна поживна речовина й протиотрута водночас. Тому її використовують для ін'єкцій під час харчових отруєнь, інфекційних захворювань тощо, зокрема шлунково-кишкових.
-Збереження стабільного рівня глюкози в крові дуже важливе для нормальної життєдіяльності організмів. Тому в людини й багатьох тварин снує складна система гормональної регуляції вуглеводного обміну. Його порушення є причиною виникнення важких хвороб, насамперед цукрового діабету. Тому важливо не лише збалансувати вживання вуглеводів, а й регулярно перевіряти рівень глюкози в крові. Для цього слід періодично звертатися до лікарів.
Фармацевт:
Також слід пам'ятати, що при надмірному надходженні в організм вуглеводи можуть виконувати і негативну роль.
- Надлишок даних речовин здатний перетворюватися в жири і відкладатися у вигляді жирової тканини, формуючи надлишкову вагу тіла. Особливо легко сприяє ожирінню такий вуглевод як цукор,
-Встановлено, що при надмірному надходженні цукру посилюється перетворення в жир всіх харчових речовин (крохмалю, жиру, їжі, частково і білка).
- Надмірне надходження цукру при харчуванні веде до підвищення рівня холестерину в крові, а також сприяє розвитку карієсу зубів.
- Негативну роль солодких продуктів харчування, що містять цукор, можна зменшити за рахунок їх заміни стравами, приготованими на основі інших вуглеводів, що становлять основу солодкуватого смаку меду, фруктів і ягід.
Дієтолог:
-Частка вуглеводів у харчуванні людини вважається оптимальною в кількості 56% від усієї калорійності добового раціону.
-Враховуючи, що 1 грам вуглеводів дає при розщепленні в організмі 4 кілокалорії, а меню для дорослої людини має забезпечувати 2600 - 3000 кілокалорій на добу, то, відповідно, за рахунок вуглеводів повинно поставлятися приблизно 1500-1700 кілокалорій. Дана енергетична цінність відповідає 375 -425 грам вуглеводів.
Отже, роль вуглеводів в справі формування раціонального харчування при веденні здорового способу життя дуже висока. Грамотне складання раціону з урахуванням необхідної кількості даних компонентів харчування забезпечить хороше самопочуття і сприятиме профілактиці ряду захворювань.
Опрацювати п. 37-38
https://www.youtube.com/watch?v=ZUhA5r7QyXs
о
30.03.2021-02.04.2021
Тема: Поняття про вищі карбонові
кислоти.
З вищих насичених кислот найбільше
значення мають пальмітинова С15Н31СООН та стеаринова С17Н35СООН
кислоти. У вигляді естерів гліцерину вони входять до складу більшості жирів,
тому й здобули назву вищих жирних кислот. Пальмітинова кислота у вигляді естеру
є складовою частиною бджолиного воску.
Пальмітинова і стеаринова кислоти – це
тверді речовини білого кольору, нерозчинні у воді, жирні на дотик, без запаху й
смаку. Але вони, виявляючи загальні властивості кислот, розчиняються у водних
розчинах лугів і карбонатів, утворюючи солі:
С17Н35СООН (стеаринова
кислоти) + КОН → С17Н35СООК (калій
стеарат) + Н2О
2С15Н31СООН (пальмітинова
кислота) + Na2CO3 → 2С15Н31СООNa (натрій
пальмітат) + Н2О + CO2
Солі вищих карбонових кислот
називають милами. Натрієві і калієві солі добре розчинні
у воді, їм властива миюча дія. Натрієві солі становлять основу твердого мила, а
калієві солі – рідкого мила. Солі жирних кислот, до складу яких входять кальцій
і магній, у воді не розчиняються. Утворенням цих солей, що випадають у осад,
пояснюється, чому мило втрачає мийну здатність у жорсткій воді, що містить
розчинні солі кальцію й магнію. Оскільки розчинні у воді солі вищих карбонових
кислот мають високу миючу здатність, їх використовують для виготовлення різних
сортів мила.Раніше ці кислоти добували виключно внаслідок переробки жирів. В
даний час необхідні для виробництва мила карбонові кислоти добувають окисненням
парафіну. Нейтралізацією кислот, які містять від 10 до 16 атомів Карбону у
молекулі, добувають туалетне мило, а з кислот, які містять від 17 до 21 атомів
Карбону – господарське мило і мило для технічних потреб.
https://www.youtube.com/watch?v=UCbLVDos70E
Опрацювати п. 36, підготуватись до практичної роботи №4 ((ст.171)
12.01.2021;15.01.2021
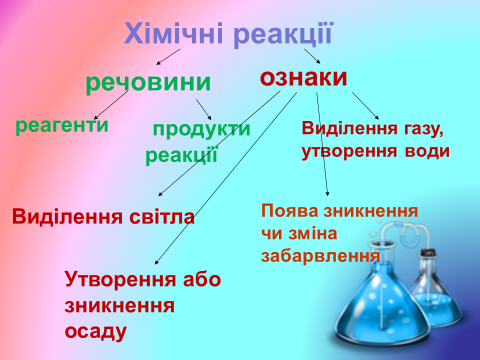
Тема: Хімічні реакції
Повторити п.18-25
19.01.2021
22.01.2021
Тема: Загальні і
відмінні ознаки органічних і неорганічних сполук. Особливості будови атома
Карбону в основному та збудженому станах. Утворення ковалентного зв’язку між атомами Карбону
Сполук Карбону в багато разів більше ніж тих, які його не містять.
Неорганічна хімія вивчає невелику кількість таких сполук, а саме: оксиди
Карбону, карбіди, карбонати, карбонатну кислоту та інші. Органічна хімія вивчає
сполуки, до складу яких обов’язково входить елемент Карбон. На відміну від
неорганічних, органічні сполуки мають ряд характерних особливостей. Перш за все
атоми Карбону здатні сполучатися одні з одними, утворюючи ланцюги й кільця, що
не типово для неорганічних сполук. Зв’язки між атомами Карбону можуть бути
простими, подвійними й потрійними. Молекули при однаковому якісному складі
можуть мати різну будову, а тому й різні властивості. Явище ізомерії –
характерна особливість сполук Карбону. В органічній хімії виділяють ряди
подібних по складу і властивостям речовин, які називають гомологами.
|
Ознаки для порівняння |
Неорганічні речовини |
Органічні речовини |
|
Елементний склад. |
Неорганічні речовини
утворюють майже всі елементи періодичної системи. |
Органічні речовини утворюють
в основному такі елементи як С, Н, О, N, яких називають
органогенами. Рідше до складу органічних сполук входять S, P та галогени. |
|
Кількість речовин. |
Близько 200 тисяч. |
Понад 10 млн. |
|
Валентність Карбону. |
Карбон проявляє валентність
ІІ і IV. |
Карбон проявляє валентність
лише IV. Атоми Карбону можуть сполучатися між собою, утворюючи молекули
різноманітної форми. |
|
Тип зв’язку,
кристалічна ґратка, фізичні властивості. |
Більшість неорганічних сполук
немолекулярної будови, тому їм притаманна висока температура кипіння й
плавлення. Тип хімічного зв’язку ковалентний, йонний або металічний. |
Органічні речовини
молекулярної будови, тому вони мають низькі тамператури плавлення. Тип
хімічного зв’язку переважно ковалентний. |
|
Хімічні властивості. |
Йонні сполуки легко
дисоціюють у воді на йони й хімічні реакції між ними проходять швидше, ніж
між органічними речовинами. Реакції йонного обміну проходять дуже швидко. |
Реакційна здатність висока,
але реакції відбуваються повільно, в кількох напрямках, в залежності від
умов,часто з утворенням різних продуктів. Майже всі органічні речовини горять
й легко розкладаються або обвуглюються при нагріванні. Це пояснюється
порівняно невеликою міцністю зв’язку між атомами Карбону (355,6 кДж). При
згорянні найчастіше утворюють СО2 й Н2О.
Здебільшого у воді не розчинні, не дисоціюють на йони. |
|
Утворення гомологів й
ізомерів. |
Явище ізомерії зустрічається
дуже рідко. |
Характерне явище ізомерії.
Утворюють ряди подібних за складом та хімічними властивостями речовин, які
називають гомологами. |
|
Фізіологічна роль. |
Необхідні в процесах
життєдіяльності організмів. |
Роль у процесах
життєдіяльності організмів особлива. |
Однак, незважаючи на істотні відмінності між органічними та
неорганічними речовинами, поділ на ці дві групи є умовним. Утворення й реакції
органічних речовин відбуваються за тими ж законами, що й для неорганічних
речовин. Органічні та неорганічні сполуки можуть взаємно перетворюватися.
Наприклад, німецький хімік Ф. Велер синтезував сечовину (продукт тваринного
походження) з неорганічних речовин. Німецький хімік Г. Кольбе синтезував з
неорганічних речовин оцтову кислоту. Французький хімік М. Бертло синтезував
жир, а російський хімік О. М. Бутлеров синтезував цукристу речовину. Ці
відкриття довели можливість синтезу органічних речовин з неорганічних поза
організмом. Таке взаємоперетворення речовин відбувається й у природніх умовах.
Наприклад, в результаті засвоєння нітрогеновмісних мінеральних добрив
утворюються органічні речовини, а вуглекислий газ в процесі фотосинтезу
зеленими рослинами перетворюється на крохмаль. В лабораторних умовах були
синтезовані мільйони сполук Карбону без участі живої матерії.
Для синтезу
органічних речовин використовують таку сировину:
- нафта
й супутні нафтові гази;
- кам’яне
вугілля;
- деревина.
Підсумок:
- До складу всіх
органічних сполук входять атоми Карбону.
- Органічних сполук
налічується більше ніж неорганічних тому, що атоми Карбону здатні
сполучатися між собою й утворювати ланцюги різної довжини і різної будови.
- Принципових
відмінностей між органічними й неорганічними речовинами не існує, тому що
можливе взаємоперетворення цих речовин.
- Учені-хіміки, які
у своїх дослідженнях спиралися на матеріалістичний світогляд, створили
наукові основи, що сприяли розвитку органічної хімії.
- Сировиною для
синтезу органічних сполук служать: нафта й супутні нафтові гази, кам’яне
вугілля, деревина.
Органічна хімія відіграє
важливе значення у створенні принципово нових видів продукції та принципово
нових технологій, нових матеріалів та фізіологічно активних речовин для потреб
медицини та сільського господарства. Зусилля науковців зосередженні на вивченні
хімічних процесів, які відбуваються у клітинах живих організмів, які складають
основу їх життєдіяльності: який механізм тих унікальних синтезів, які
відбуваються у організмі за допомогою ферментів; у організмі синтезуються
білкові речовини з поживних речовин, які поступають з продуктами харчування;
які процеси лежать у основі перетворення енергії, яка вивільняється під час
хімічних реакцій у організмі, в інші форми енергії, наприклад у механічну, з
вражаючи високим коефіцієнтом дії.
На даному етапі розвитку
органічної хімії уже досягненні певні результати: синтетично отримані речовини
білкової природи, нуклеїнові кислоти, вивчений принцип передачі спадкових при
знаків.
Початок розвитку
органічної хімії можна вважати середину XIX ст. До нашого часу вважалося,
що органічні речовини можуть синтезуватися тільки завдяки «життєвій силі» у
живих організмах (віталістична теорія). У 1828 році німецький
хімік Велер синтезував з неорганічних речовин амоніака та чадного газу
сечовину, чим заперечив існуючу теорію і підштовхнув до самостійного розвитку
окремої галузі хімії – органічна хімія.
Для з’ясування відмінності складу, будови,
властивостей органічних та неорганічних речовин розглянемо їх порівняльну
характеристику.
Спільні ознаки
органічних та неорганічних речовин
1.За нормальних умов можуть перебувати у будь якому
агрегатному стані.
2.Характерні типи хімічних реакцій:
o сполучення;
o заміщення;
o обміну;
o розкладу.
3.Хімічні реакції можуть бути:
o оборотні та необоротні;
o екзо – та ендотермічні;
o окисно – відновні;
o каталітичні.
4.Хімічні реакції відбуваються за законом збереження
маси речовини.
5.З неорганічних речовин можна отримати органічні і
навпаки.
|
Насичені – алкани(між атомами С одинарні зв’язки) – циклоалкани (атоми С
утворюють ланцюг циклічної форми |
Ненасичені – алкени(між атомами С подвійний
зв’язок – алкіни(між атомами С потрійний
зв’язок – алкодієни(між атомами С два
подвійних зв’язки |
Ароматичні – бензен |
Оксигеновмісні (атом оксисену входить до
складу функціональної групи, яка сполучена з карбоновим ланцюгом) – спирти – альдегіди – карбонові кислоти – естери – етери – вуглеводи Cn(H2O)m |
Нітрогеновмісні (атом нітрогену входить до складу
функціональної групи,яка сполучена з карбоновим ланцюгом) – аміни – амінокислоти – білки |
Карбон на відміну від інших хімічних
елементів здатний утворювати величезну кількість органічних
сполук. Причина в тому, що атоми Карбону здатні:
1. з’єднуватися
один з одним у ланцюги різної будови — відкриті (нерозгалужені, розгалужені), замкнені:
CH3-CH2-CH3
CH2-CH3
CH3-CH-CH3 H2C─CH2
|
| │ │
CH3
CH3
H2C─CH2
2. утворювати
не лише прості (одинарні), але й кратні (подвійні, потрійні)
зв’язки:
H3C −CH3,
H2C = CH2, H − C ≡ C – H
3. утворювати
міцні зв’язки майже з будь-яким іншим елементом.
Це
пояснюється тим, що :
по – перше на зовнішньому енергетичному рівні атом
Карбону має чотири електрони (2s і 2p) (тому атом Карбону не схильний ні віддавати, ні
приєднувати вільні електрони з утворенням йонів);
по – друге дрібний розмір атома (порівняно з іншими елементами IV групи).
Внаслідок цього Карбон
утворює переважно ковалентні, а не йонні зв’язки, і проявляє валентність IV, а
валентність ІІ проявляє дуже рідко.
БУДОВА АТОМА КАРБОНУ В НЕ ЗБУДЖЕНОМУ І
ЗБУДЖЕНОМУ СТАНАХ
В не збудженому стані на другому останньому енергетичному рівні
в атомах Карбону знаходяться два спарених s – електрони, два р – електрони і
два неспарених р – електрони, тому участь в утворенні зв’язків беруть участь
тільки два неспарених р – електрони. Валентність Карбону в таких сполуках
дорівнює ІІ, ступінь окиснення +2(C+2O-2).
+6C 1S22S22p2
|
↑ |
↑ |
↑ |
||
|
↑↓ |
2p |
|||
|
↑↓ |
2S |
|||
|
1S |
В збудженому стані s – електрони з 2s – підрівня
розпарюються і один електрон займає вільну орбіталі на 2р – підрівні:
+6C* 1S22S12p3
|
↑ |
↑ |
↑ |
||
|
↑ |
2p |
|||
|
↑↓ |
2S |
|||
|
1S |
Таким чином участь в утворенні зв’язків можуть брати
всі чотири електрони. Але в залежності від типу гібридизації, тобто
вирівнювання електронних хмар розрізняють три валентних стани атома Карбону:
І валентний стан. Один s – електрон, що має форму кулі і три
р – електрони, що мають форму об’ємних вісімок гібридизуються, тобто
вирівнюються і приймають однакову форму форму несиметричної вісімки. Такий тип гібридизації називається sp3 –
гібридизація
Валентні
гібридизовані електрони розміщуються в просторі під кутом 109°28´. Такі
електрони перекриваються в одній площині або між таким ж гібридизованими
електронами, або ж з іншими типами електронами утворюючи σ – зв’язки, так
як наприклад в молекулі етану(H3C─CH3):
ІІ валентний стан. Атоми Карбону знаходяться в стані sp2 –
гібридизації. При sp2 – гібридизації вирівнюються
три електрони один s – електрон і два р – електрони,які приймають форму
несиметричної вісімки, а один р – електрон залишається не гібридизованим. Гібридизовані
електрони розташовані в просторі під кутом 120
ІІІ валентний стан. Атоми Карбону знаходяться в стані sp –
гібридизації. При sp – гібридизації вирівнюються тільки
два електрони один s – електрон і один р – електрон,які приймають форму
несиметричної вісімки, а два р – електрони залишаються не
гібридизованими. Гібридизовані електрони розташовані в просторі під
кутом 180
Таким чином в
сполуках, будь – то в неорганічних, будь – то в органічних, до складу яких
входять атоми Карбону в збудженому стані незалежно від типу гібридизації, їх
валентність завжди дорівнює ІV, а от ступінь окиснення буде дорівнювати від -4
до +4, а в органічних сполуках може бути навіть десятковим дробом(С-4H+14,
С+4О-22, С-2,54H+110).
Опрацювати п.26.
виконати завдання №99 на ст 133.










Немає коментарів:
Дописати коментар