Хімія 9 клас
https://meet.google.com/kyf -hwgs - pzp - посилання на онлайн уроки (за розкладом)
24.05.2022 - 26.05.2022
Тема: Роль хімії в житті суспільства.17.05.2022 - 19.05.2022
Тема: Місце хімії серед наук про природу.Роль хімічних знань у пізнанні природи. Значення хімічних процесів у природі.Місце хімії серед наук про природу зумовлене предметом її вивчення й тісними зв'язками з іншими науками. Опановуючи в основній школі ази цієї дивовижної науки, ви неодноразово пересвідчувалися: хімія вивчає склад, властивості й перетворення речовин, а також явища, які супроводжують ці перетворення.
Ви вже маєте елементарні уявлення про будову атома, типи хімічних зв'язків, окисно-відновні реакції, тому усвідомлюєте обґрунтованість визначення: хімія — наука про перетворення речовин, зумовлені зміною електронного оточення атомних ядер.
• Як пов'язана хімія з іншими науками? Забезпечуючи їх речовинами, матеріалами та сучасними технологіями, хімія водночас використовує здобутки математики, фізики, біології, екології для власного подальшого розвитку. Тож хімія є центральною, фундаментальною наукою (мал. 38.1).
Місце хімії серед наук про природу зумовлене предметом її вивчення й тісними зв'язками з іншими науками. Забезпечуючи їх речовинами, матеріалами та сучасними технологіями, хімія водночас використовує здобутки математики, фізики, біології, екології для власного подальшого розвитку. Тож хімія є центральною, фундаментальною наукою. Жодну природничу науку наразі не можна назвати лідером. Система наукових знань про природу й система методів кожної з наук перебувають у процесі безперервного взаємозбагачення. Сучасна хімія - високо-впорядкована система знань, що стрімко й цілеспрямовано розвивається у взаємодії із системами знань інших наук. Хімічний експеримент - ефективний метод одержання знань, засіб перетворення їх у переконання, невичерпне джерело розвитку наукового світогляду. Вагомий внесок зробили хіміки в розвиток високих технологій. Хімія, так само як й інші природничі науки, - засіб формування світогляду. Розвитку творчого потенціалу та інтуїції, які необхідні для розв'язання наукових завдань, сприяє прилучення до мистецтва - живопису, музики, літератури тощо. Порятунок людства від глобальних криз сьогодення й запобігання їм у майбутньому - у розвитку високої духовності. Д.З. повторити матеріал підручника, сайту, відео |
Кожен нуклеотид складається з нітрогеновмісної основи, п'ятикарбонового сахариду (пентози) і ортофосфатної групи (залишку ортофосфатної кислоти).
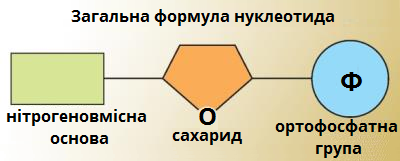
Залежно від виду пятикарбонового сахариду (пентози), розрізняють два типи нуклеїнових кислот:
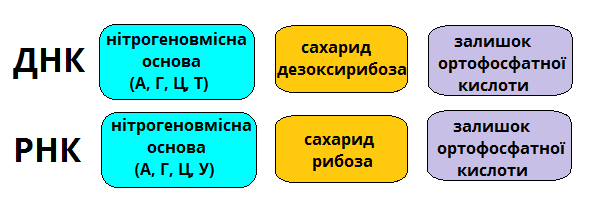
- дезоксирибонуклеїнові кислоти (скорочено ДНК) — молекула ДНК містить п'ятикарбовновий сахарид — дезоксирибозу.
- рибонуклеїнові кислоти (скорочено РНК) — молекула РНК містить п'ятикарбоновий сахарид — рибозу.
Нуклеотиди ДНК: А — аденін, Г — гуанін, Ц — цитозин, Т — тимін.
Нуклеотиди РНК: А — аденін, Г — гуанін, Ц — цитозин, У — урацил.
Просторова структура молекули ДНК була змодельована американськими вченими Джеймсом Уотсоном і Френсісом Криком у
Дезоксирибонуклеїнова кислота (ДНК) — складається з двох спірально закручених ланцюгів, які по всій довжині сполучаються один з одним водневими зв'язками. Таку структуру (властиву тільки молекулам ДНК), називають подвійною спіраллю. Кожен «крок» подвійної спіралі ДНК становить
Рибонуклеїнова кислота (РНК) — лінійний полімер, що складається з одного ланцюга нуклеотидів.
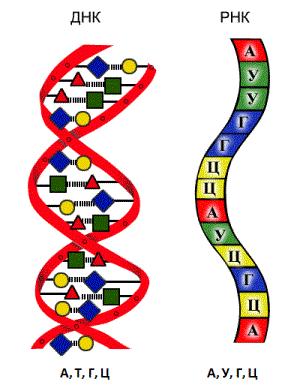
Винятком є віруси, у яких зустрічаються одноланцюгові ДНК і дволанцюгові РНК.
Органічні речовини, що містять в молекулах атоми Нітрогену, називаються нітрогеновмісними сполуками.

Амінокислоти - це органічні речовини, що містять в молекулах аміногрупу - NH2 та карбоксильну групу - COOH. Ці групи є функціональними групами амінокислот. В молекулі їх може бути по одній або більше.
Найпростішим представником амінокислот є амінооцтова (аміноетанова) кислота: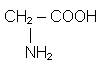
Приклади інших амінокислот: 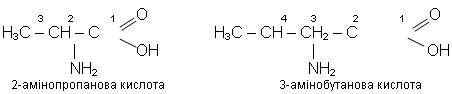
У живій природі найбільше значення мають амінокислоти, у яких аміногрупа розміщена в положенні (2) - біля атома Карбону, безпосередньо з'єднаного з карбоксильною групою. Таке положення ще називають α - положенням, а відповідні кислоти - α-амінокислотами. α-амінокислоти, що входять до складу білків, мають свої назви. Наприклад, амінооцтова кислота - гліцин, α-амінопропанова кислота - аланін тощо.
Фізичні властивості амінокислот. Амінокислоти - це безбарвні кристалічні речовини, солодкі на смак, добре розчинні у воді. Плавляться із розкладанням при високих температурах (вище 250?С).
Хімічні властивості амінокислот. Розглянемо на прикладі амінооцтової кислоти.1. Амфотерні властивості.
- Пригадайте з неорганічної хімії: амфотерними називаються сполуки, що проявляють подвійні (основні і кислотні) властивості.
Вам відома здатність карбонових кислот взаємодіяти з лугами за рахунок карбоксильних груп та утворювати солі. Таку ж властивість проявляють і амінокислоти:
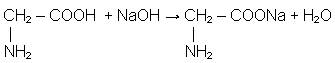
Аміногрупа, навпаки, наділена основними властивостями (здатністю приєднувати йон Н+ до неподіленої електронної пари атома Нітрогену). Тому амінокислоти реагують також і з кислотами, утворюючи солі:
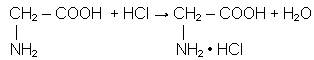
Отже, завдяки наявності двох різних за хімічним характером функціональних груп амінооцтова та інші амінокислоти взаємодіють і з лугами, і з кислотами (проявляють амфотерні властивості).
Чи змінюють розчини амінокислот колір індикаторів? Якщо кількість карбоксильних і аміногруп в молекулі амінокислоти однакова, то вони взаємно нейтралізують одна одну. В такому випадку колір індикатора не зміниться. Якщо кількісно переважають карбоксильні групи, індикатор покаже кисле середовище; якщо аміногрупи - лужне.
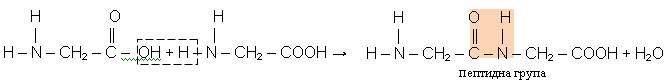
За рахунок пептидної групи одна молекула амінокислоти приєдналася до другої, і при цьому утворився дипептид і вода. Таким способом можуть сполучатись між собою не тільки дві, а і більше молекул різних амінокислот, утворюючи поліпептиди. Ця унікальна властивість амінокислот забезпечила існування в природі білків, які за своєю хімічною природою є поліпептидами.
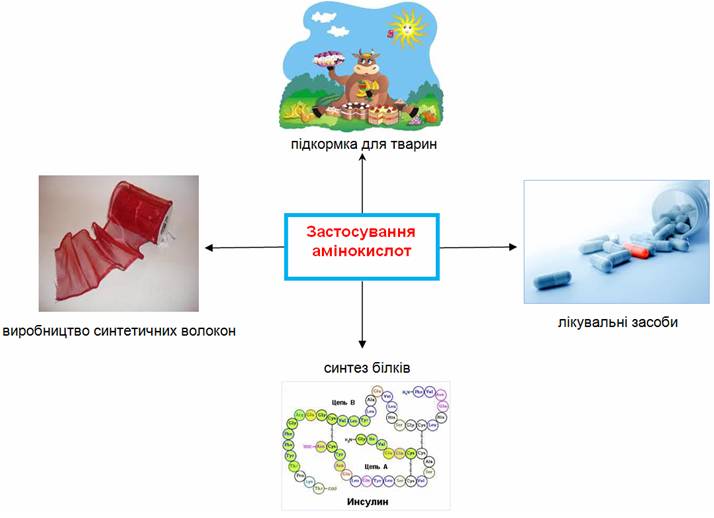
Застосування амінокислот. Амінокислоти необхідні для побудови білків живого організму. Люди і тварини отримують їх із білковою їжею. Багато амінокислот застосовують в медицині як лікувальні засоби, а деякі використовуються в сільському господарстві для підкормки тварин. Із аміногексанової кислоти виготовляють синтетичне волокно капрон.
До складу білків обов'язково входять чотири хімічні елементи: Карбон, Гідроген, Оксиген і Нітроген. Багато білків містять ще і Сульфур. До складу деяких входить Фосфор. Є білки, що містять атоми металів.
Амінокислотні залишки сполучаються у макромолекули білків у різній послідовності. Число амінокислотних залишків у молекулах теж може бути різним. Тому різноманіття білків є практично безмежним. Кожен організм на Землі має свій власний неповторний набір білків.
1.Позначте формулу етилового спирту:
А. С2Н5ОН; Б. НСООН; В. СН3СООН; Г. С17Н35СООН.
2. Загальна формула насичених одноосновних карбонових кислот:
А. Сп(Н2О)m; Б. R1CООR2; В. СпН2п+1СООН; Г. СпН2п +1ОН.
3. Функціональна группа спиртів:
![]()
![]()
![]()
![]()
![]()
![]() О О О
О О О
![]()
![]()
![]() А. –ОН; Б. ─С В. ─С Г. ─С
А. –ОН; Б. ─С В. ─С Г. ─С
ОН; Н; О─ .
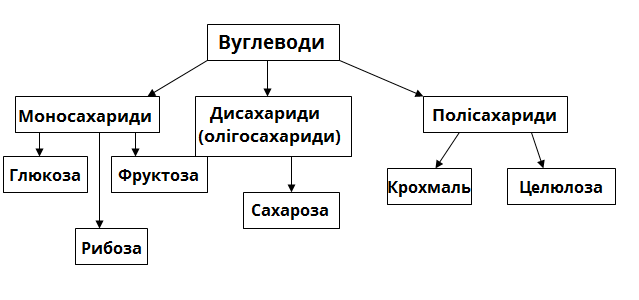
4 . Сахароза – це органічна речовина, що належать до класу:
1 | 2 | 3 | 4 | 5 | 6 | |
А | ||||||
Б | ||||||
В | ||||||
Г |
А. спиртів; Б. естерів; В. карбонових кислот; Г. вуглеводів.
5. Яким реактивом можна скористатися, щоб виявити
крохмаль серед інших речовин:
А. лакмус; Б. спиртовий розчин йоду ;
В Сu(ОН)2; Г. бромна вода.
6. Целюлоза належить до:
А. моносахаридів; Б. дисахаридів; В. полісахаридів.
Завдання 7 – 9 можуть мати дві і більше правильні відповіді. Оберіть правильні відповіді і позначте їх у бланку відповідей.
7. (0,5 б.) Виберіть властивості, які притаманні крохмалю:
А. Білий порошок; Б. Добре розчинний у воді;
В. Молекули мають лінійну і розгалужену будову;
Г. З гарячою водою утворює клейстер.
7 | 8 | 9 | |
А | |||
Б | |||
В | |||
Г |
8. (0,5 б.)Виберіть галузі застосування целюлози:
А. Виготовлення паперу; Б. Продукт харчування людини
В. Виробництво штучних волокон;
Г. У медицині для виготовлення мазей і присипок.
9. (1б.) Позначте речовини, з якими може реагувати оцтова кислота:
А. Mg; Б. Сu; В. Са(ОH)2; Г. С2Н5ОН.
10.(2б.)Закінчити рівняння реакцій:
А. С2Н5ОН + HCl →; В. СН3СООН + Nа → ;
Б. С12Н22О11 + Н2О → ; Г. С17Н33СООН + Н2 → .
11.(2б.) Здійснити перетворення:
СО2 → С6Н12О6 → (С6Н10О5)n → С6Н12О6 → СО2.
12. (3б.) Обчисліть об’єм вуглекислого газу, який виділиться внаслідок спиртового бродіння 400г глюкози, що містить 10 % домішок (н. у.)
Крохмаль
Целюлоза
( С6Н10О5)n
Порівняльна характеристика
| Крохмаль | Целюлоза |
Походження назви | Від нім. kraft – «сила», mehl – «мука». Це складова частина муки, яка надає їй силу. | Від лат. celula – «клітина» або «комірка». |
Формула, структурні ланки | (С6Н10О5)n | (С6Н10О5)n |
Будова молекули, форма, ступінь полімеризації | Природний полімер лінійної й розгалуженої будови. Мr – кілька сотен до тисяч. Ступінь полімеризації – від 1000 до 5000. | Природний полімер лінійної будови. Мr – кілька мільйонів. Ступінь полімеризації – від 10000 до 14000. |
Поширення в природі | Продукт фотосинтезу: Запасна поживна речовина рослин. Вміст в картоплі – до 24%, пшениці – до 75%, рису – до 86%. Синтезується із глюкози. | Продукт фотосинтезу. Основна складова частина оболонок рослин, яка надає міцність і еластичність. Вміст у бавовні, ваті, фільтрувальному папері – 98%, у деревині – 45%, листі рослин – 10-12 %. |
Физичні властивості | Білий порошок, не розчинний у воді, набрякає у гарячій воді, утворюючи колоїдні розчини. | Волокниста речовина, не розчинна у воді, стійка до розчинів кислот, лугів й слабких окиснювачів. Обвуглюється концентрованою Н2SO4. |
Хімічні властивості | 1. Повний гідоліз (кислотний): 2. Ферментативний гідроліз 3. Якісна реакція: поява синього забарвлення із спиртовим розчином йоду. | 1. Гідроліз: 2. Горіння: 3. Термічний розклад: без доступу повітря на метанол, ацетон, оцтову кислоту. 4. Реакція нітрування: |
Застосування
| Продукт харчування – джерело енергії. Декстрини – для виготовлення клею, обробки тканин. Патока – у кондитерській справі. Крохмаль – для виробництва глюкози, спирту, пива, кетчупів. У медицині – для приготування присипок, паст, капсул, лікарських препаратів. | Будівельний матеріал, паливо. Як сировина для виробництва штучних волокон, кіноплівки, нітролаків, смол, глюкози, кормових дріжджів, бездимного пороху, паперу, тканин, спирту. |
Жири – естери трьохатомного спирту гліцеролу та вищих карбонових кислот.
Склад жирів
До складу молекули жиру входять залишки гліцеролу та карбонових кислот. R – радикал кислоти, що містить від 3 до 25 атомів Карбону. Цікаво, що до складу природних жирів входять карбонові кислоти лише з парним числом атомів Карбону. Найпоширеніші кислоти, що входять до складу жирів:
Фізичні властивості жирів
1) Тваринні жири – тверді ( виняток – риб’ячий жир),
Рослинні жири – рідкі ( виняток – кокосове масло).
2) Легші за воду.
3) Нерозчинні у воді, але розчиняються в органічних розчинниках, наприклад, в бензині
4) Добре вбирають запахи, (тому застосовуються в парфумерії).
Біологічна роль жирів:
1) Жири – джерело енергії 1г жиру + О2 → СО2 + Н2О + 37,7 кДж
2) Жири входять до складу клітинних компонентів, зокрема мембран.
3) Жири виконують захисну функцію. Захищають від механічних пошкоджень, втрати тепла (у кита під шкірою шар жиру товщиною 0,5 м.)
4) Жир – джерело води в організмі. 1кг жиру + О2 → 1,1кг Н2О
5) Жири – технічна сировина (1/3 частина жирів перетворюється на гліцерин, мила, карбонові кислоти тощо)
6) Жири – головний будівельний матеріал для дитячого мозку, що розвивається.
7) За відсутності в їжі достатньої кілдькості жирів порушується діяльність центральної нервової системи, послаблюється імунітет.
8) Жири роблять шкіру гладенькою і еластичною, волосся – здоровішим і блискучішим.
Застосування жирів:
o харчова промисловість;
o маргарин;
o у домашніх умовах;
o мило;
o гліцерин;
o медицина;
o оліфа;
o косметичні засоби.
Оливкова олія використовується для лікування гастритів, язв, захворювань печінки, жовчних протоків, шлунка. Вершкове масло не можна виключати з раціону при захворюваннях нирок, атеросклерозом, гіпертонічною хворобою. Жири ми використовуємо у своєму раціоні.
З позиції лікувального харчування корисними є жири, які утворені ненасиченими кислотами. Необхідно використовувати рослинні масла з великим вмістом лінолевої кислоти C17H31COOH, олеїнової С17Н33СООН. Ознайомимось з таблицею.
Основна функція вуглеводів — енергетична (при розщепленні і окисненні молекул вуглеводів виділяється енергія, яка забезпечує життєдіяльність організму). Під час окиснення
Загальна формула вуглеводів:
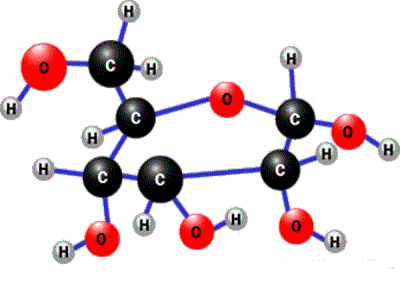
сахароза (глюкоза
Лактоза (глюкоза
Мальтоза (глюкоза


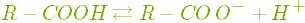 .
.Карбонові кислоти — слабкі електроліти і слабкі кислоти. Найсильніша з них, метанова, відноситься до кислот середньої сили. Зі збільшенням числа атомів Карбону в молекулі сила кислот зменшується.
У хімічних реакціях з багатьма речовинами утворюються солі карбонових кислот. Солі мурашиної кислоти — форміати (метаноати), солі оцтової кислоти — ацетати (етаноати).
- Змінює забарвлення індикаторів.
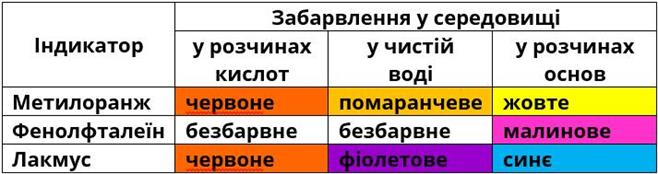
- Взаємодіє з деякими металами (
Mg,Zn,Al ) з виділенням водню і утворенням солей (етаноатів, або ацетатів):

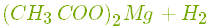 .
.
- Реагує з основними оксидами з утворенням солі і води:

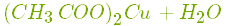 .
.
- Вступає у реакцію нейтралізації з основами:
 .
.- Взаємодіє з карбонатами. Реакція відбувається з виділенням вуглекислого газу:

 .
.
До оксигеновмісних органічних речовин належать спирти. Це речовини, молекули яких, окрім Карбону й Гідрогену, містять ще й атоми Оксигену. Найпростіший склад і будову мають спирти, що містять гідроксильні групи —ОН. Спирти поділяють на одно- й багатоатомні. Розглянемо їх склад і будову на прикладі метанолу, етанолу та гліцеролу.
Склад і будова молекул метанолу. Метанол — найпростіший представник класу спиртів. Ного молекулярна формула СН3—ОН. Молекула метанолу містить групу атомів —СН3 і функціональну гідроксильну групу —ОН, характерну для спиртів. Метанол належить до одноатомних спиртів. Його структурна формула:

З молекулярної та структурної формул і кулестержневої моделі бачимо, що метанол можна розглядати як похідну метану, у молекулі якого один атом Гідрогену заміщено на гідроксильну групу (рис. ).

Рис. Кулестержнева модель молекули метанолу
Фізичні властивості метанолу. Наявність у молекулі гідроксильної групи впливає на фізичні властивості метанолу. За її участю відбувається поляризація хімічного зв’язку, що зумовлює утворення водневих зв’язків. (Полярність зв’язку в гідроксильній групі пояснено на прикладі молекули етанолу). Унаслідок полярності окремих молекул спиртів не існує, вони утворюють цілі агрегати. Утворення водневих зв’язків також пояснює відсутність серед спиртів газів.
• Пригадайте, який зв’язок називають водневим.
Порівняно з відповідними їм вуглеводнями, спирти мають високі температури кипіння. Метанол за звичайних умов є безбарвною, прозорою рідиною з характерним запахом. Завдяки утворенню водневих зв’язків метанол добре розчинний у воді в будь-яких відношеннях.
Ознайомимося ще з одним представником спиртів — етанолом.
Склад і будова молекул етанолу. До спиртів, що містять у своєму складі одну функціональну групу атомів —ОН, належить етанол. Як і метанол, це одноатомний спирт, а гліцерол — представник багатоатомних спиртів.
Етанол — органічна сполука, яку можна розглядати як похідну етану, у молекулі якого один атом Гідрогену заміщено на гідроксильну групу —ОН (рис. ).

Рис. Кулестержнева модель молекули етанолу
Складемо структурні формули етану й етанолу та порівняємо їхній склад.

На рисунку зображено масштабну модель молекули етанолу. Обидві моделі демонструють, що в молекулі етанолу є тільки одна гідроксильна група, що підтверджує належність його до одноатомних спиртів.

Рис. Масштабна модель молекули етанолу
Окрім того, зі структурних формул метанолу й етанолу бачимо, що у їхніх молекулах атоми Карбону — чотиривалентні.
Органічні речовини, у молекулах яких є одна або кілька гідроксильних груп, називають спиртами.
Скорочена структурна формула етанолу СН3—СН2—ОН.
Проаналізуємо утворення ковалентного полярного зв’язку між Оксигеном і Гідрогеном у гідроксильній групі.
Атом Оксигену, як атом більш електронегативного елемента, зміщує до себе спільну пару електронів зв’язку О—Н. Тому атом Оксигену набуває частковий негативний заряд, а атом Гідрогену — частковий позитивний. Їх позначають відповідно δ- (читають «дельта мінус») і δ+ (читають «дельта плюс»). Зміщення пари електронів позначають стрілкою, спрямованою до більш електронегативного елемента.

Отже, молекула етанолу — полярна. Це впливає на властивості речовини та класу речовин, до якого етанол належить.
Фізичні властивості етанолу. Етанол (етиловий спирт) — це безбарвна рідина, добре розчинна у воді в будь-яких відношеннях. Прозора, має характерний запах. Температура кипіння низька й становить +78,4 °С, однак значно вища від температури кипіння етану. Густина етанолу менша за густину води й становить приблизно 0,8 г/мл.
Утворення водневого зв’язку між молекулами спиртів показано на прикладі етанолу (рис. ), а між молекулами води й етанолу — на рисунку .

Рис. Схема утворення водневого зв’язку між молекулами етанолу

Рис. Схема утворення водневого зв’язку між молекулами етанолу й води
Унаслідок утворення водневого зв’язку між молекулами спиртів утворюються асоційовані молекули. Водневий зв’язок утворюється і між атомом Гідрогену гідроксильної групи молекули спирту, на якому концентрується частковий позитивний заряд однієї молекули, й атомом Оксигену в складі води іншої молекули, на якому зосереджений частковий негативний заряд. Такий зв’язок, як вам відомо, називають міжмолекулярним. Завдяки водневому зв’язку рідкі спирти добре розчинні у воді.
Хімічні властивості етанолу. Вам уже відомо, що властивості речовин залежать від їх будови. Тому властивості етанолу зумовлені складом молекули, яка містить групу —ОН і залишок насиченого вуглеводню етану —С2Н5.
Усі органічні речовини горять. Виконаємо демонстраційний дослід.
Дослід 1. Горіння етанолу. Наллємо етанол на дно чашки Петрі й обережно запалимо його. Як легкозаймиста речовина, він швидко спалахує й горить блакитним, ледь помітним полум’ям із виділенням великої кількості тепла (рис.). Рівняння реакції:
С2Н5ОН + 3О2 → 2СО2 + 3Н2О; ΔΗ = -715 кДж/моль.

Рис. Горіння етанолу
Склад і будова молекули гліцеролу. Гліцерол — триатомний спирт, тобто в його молекулі міститься не одна, як у метанолу й етанолу, а три функціональні групи —ОН. Гліцерол можна розглядати як похідну пропану, у молекулі якого біля кожного атома Карбону один атом Гідрогену заміщений на гідроксильну групу (рис.).

Рис. Кулестержнева модель молекули гліцеролу

Рис. Масштабна модель молекули гліцеролу
Складемо структурні формули пропану та гліцеролу й запишемо скорочену структурну формулу гліцеролу:

Фізичні властивості гліцеролу. Гліцерол — рідина без запаху та кольору, солодка на смак, в’язка, необмежено змішується з водою, має гігроскопічні властивості (здатна вбирати воду з повітря). В’язкість гліцеролу, порівняно з етанолом, зумовлена наявністю трьох гідроксильних груп, які утворюють більше водневих зв’язків.
Виконаємо демонстраційний дослід 2.
Дослід 2. Розчинність гліцеролу у воді. Наллємо в пробірку воду об’ємом 0,5-1 мл. Додамо кілька крапель гліцеролу й перемішаємо суміш. Додамо ще кілька крапель гліцеролу та знову перемішаємо.
За результатами дослідження можна зробити висновок, що гліцерол добре розчинний у воді.
Хімічні властивості гліцеролу. Хімічні властивості гліцеролу, як і фізичні, зумовлені наявністю трьох гідроксильних груп. Тому властивості гліцеролу подібні до хімічних властивостей етанолу, тобто одноатомних спиртів.
Гліцерол горить майже безбарвним полум’ям, незважаючи на високий вміст Карбону. Рівняння реакції:
2С3Н8О3 + 7О2 → 6СО2 + 8Η2О; ΔΗ < 0.
Гліцерол взаємодіє з купрум(ІІ) гідроксидом з утворенням купрум(ІІ) гліцерату яскраво-синього кольору (рис. ).

Рис. Купрум(ІІ) гліцерат
Отруйність метанолу й етанолу. Згубна дія алкоголю на організм людини. Метанол (деревний спирт) є сильною отрутою. Потрапляння в організм людини викликає захворювання судинної та нервової систем. Має здатність проникати крізь неушкоджену шкіру. Незначна доза метанолу спричиняє сліпоту й навіть смерть.
Етанол — спирт, який чинить наркотичну дію на організм людини. Вивчаючи основи здоров’я та біологію, ви дізналися, що систематичне вживання спиртних напоїв призводить до хронічного отруєння організму і як наслідок до захворювання — алкоголізму. Хворобу спричиняє здатність етанолу добре розчинятися, а отже, і легко всмоктуватися в кров, яка розносить його до всіх органів. У печінці спирти окиснюються до альдегідів — токсичних речовин, які спричиняють таку важку недугу, як цироз (руйнування клітин печінки).
За тривалого вживання спиртів уражаються всі органи: погіршується робота серця та нирок, нервової та серцево-судинної систем. Знижується апетит, виникають зміни в органах травлення. У людини, яка систематично вживає алкоголь, спостерігаються послаблена увага, некоординовані рухи, гальмується робота головного мозку.
Особливу шкоду алкоголь завдає здоров’ю дітей та підлітків. Вживання його знижує гостроту зору та слуху, затримує ріст і розумовий розвиток, може викликати страшне захворювання — недокрів’я.
Щоб запобігти цій небезпеці, кожна людина має усвідомити згубну дію алкоголю та свідомо вести здоровий спосіб життя. Це допоможе вирішити дві проблеми суспільства: медичну й соціальну.
Застосування етанолу. Етанол і гліцерол — спирти, що мають важливе значення. Галузі застосування етанолу показано на рисунку .

Рис. Схема застосування етанолу
Ознайомимося докладніше з кожною галуззю застосування етанолу.
У медицині етанол застосовують для виготовлення лікувальних препаратів, для знезараження поверхні тіла під час операцій, аналізу крові, дезінфекції хірургічних інструментів і рук лікаря. Антисептичну дію етанолу використовують для консервування біологічних препаратів.
Етанол — альтернативне джерело енергії для двигунів внутрішнього згоряння, оскільки він, порівняно з бензином, є екологічно чистим. Додавання до бензину 10 % етанолу заощаджує використання нафти.
Етанол використовують як розчинник для виготовлення екстрактів із рослин, настоянок із лікувальних трав, їхніх квітів чи насіння.
У парфумерії етанол — основний компонент ароматичних косметичних засобів (парфумів, одеколонів, парфумованої води тощо). Набули поширення дезодоранти — засоби проти поту. У побуті етанол придатний для виведення жирних плям.
У харчовій промисловості його використовують як консервант.
Досить широкий спектр застосування етанолу як сировини в органічному синтезі. Значну його кількість витрачають на синтез етанової (оцтової) кислоти, синтетичних каучуків, гуми, пластмас, естерів.
Застосування гліцеролу. Гліцерол — триатомний спирт, який використовують у фармацевтичній промисловості для виготовлення мазей, гелів і кремів. З гліцеролу одержують нітрогліцерол — судинорозширювальний засіб, що у формі таблеток чи капсул застосовують у разі захворювання серця. Цю саму речовину використовують і для виробництва вибухових речовин.
Гліцерол, як і етанол, — хороший розчинник. Тому його теж застосовують для виведення плям органічного походження.
Як пом’якшувальний засіб, гліцерол використовують для виготовлення кремів, помад, зубних паст, туалетного мила. У легкій промисловості — для вичинення шкур, для пом’якшення ниток.
У харчовій промисловості гліцерол додають до лікерів, хлібобулочних, макаронних і кондитерських виробів.
Сполуки Карбону із Гідрогеном:
а) вуглеводи;
б) полімери;
в) вуглеводні;
г) ізомери.
2. Укажіть елементи-органогени:
а) С та H;
б) Ca та O;
в) N та Si;
г) K та C.
3. Укажіть тип кристалічних граток, характерний для органічних речовин:
а) атомний;
б) металічний;
в) йонний;
г) молекулярний.
4. Вкажіть тип реакції, характерний для алканів:
а) приєднання;
б) естерифікація;
в) заміщення;
г) гідратація.
5. Між атомами Карбону утворюються різні типи зв’язків:
а) одинарні С-С;
б) подвійні С=С;
в) потрійні С ≡С;
г) усі відповіді неправильні.
6. На малюнку зображення вуглеводня, дайте йому назву:
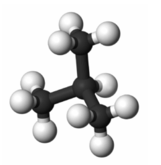
а) пропан;
б) октан;
в) 2 -бутіл;
г) бутан.
ІІ рівень
(Кожне завдання оцінюється по 1 бали)
7. Охарактеризуйте склад природного газу.
8. Використання метану.
ІІІ рівень
(Завдання оцінюється у 2 бали)
9. Встановіть відповідність:
Хімічна формула Назва радикалу
А) C2H2 1. Бутен
Б) С4Н8 2. Ацетилен
В) C2H5 3. Етіл
4. Пропіл
IV рівень
(Завдання оцінюється у 3 бали)
10. Визначте об'єм кисню, необхідного для спалювання 13,2 л (н.у.) пропану.
Варіант А - В
– завдання 1-6 – тестові, кожне завдання оцінюється в 0,5 бала, загалом перші шість завдань – 3 бали;
– завдання 7-9 оцінюються по 2 бали кожне, загалом за дев’ять правильно виконаних завдань – 9 балів;
– завдання 10 пропонується виконувати учням, які претендують на оцінку 12 балів, оцінюється в 3 бали.
Отже, максимальна оцінка за правильно виконану роботу становить 12 балів.
Час на виконання роботи – 40 хв.
1. Загальна формула етиленових вуглеводнів – …
2. Гібридизація – це явище змішування. з утворенням однакових…
3. Назвіть тип ізомерії, характерний для алкінів:
А) структурна;
Б) положення кратного зв’язку;
В) просторова;
Г) міжкласова.
4. Установіть відповідність.

A. 2-метилпропан
Б. Пропен
B. 1-хлор-1-бутен
Г. 3-метил-1-бутин
5. Реакція описується рівнянням: 
Укажіть, який об’єм хлору приєднається до 5 л ацетилену:
А) 5 л;
Б) 10 л;
В) 2,5 л;
Г) 22,4 л.
6. Метан застосовують:
А) як паливо;
Б) як ліки;
В) для зварювання металів;
Г) як сировину хімічного синтезу.
7. Напишіть два ізомери та два найближчі гомологи до речовини:

8. Напишіть рівняння реакцій, необхідних для здійснення перетворень:

9. Визначте молекулярну формулу вуглеводню, якщо масова частка Гідрогену в ньому становить 17,2 %, а відносна густина за азотом – 2,07.
10. Обчисліть об’єм етану, який можна одержати в результаті взаємодії 10 л етилену й 5 л водню (н. у.).
Під час вивчення конденсованих залишків світильного газу, який одержували з кам’яного вугілля, М. Фарадей у 1825 році виділив вуглеводень із температурою кипіння 80 °С і визначив співвідношення Карбону й Гідрогену в ньому як 1:1. У 1834 році Е. Мітчерлі в результаті нагрівання солей бензойної кислоти одержав подібний вуглеводень і дав йому назву бензин. Згодом Ю. Лібіх запропонував називати цю речовину бензеном.
Молекулярна формула бензену — C6H6.
Бензен мав своєрідний запах і проявляв дивні хімічні властивості. Незважаючи на свою «ненасиченість», бензен важко вступав у реакції приєднання, але легко давав реакції заміщення атомів Гідрогену. Тому бензен та його похідні виділили в спеціальний клас, якому дали назву «ароматичні вуглеводні», або «арени».
Першим структурну формулу бензену запропонував у 1865 році німецький хімік А. Кекулє:

Сучасні дослідження будови молекули бензену показали, що молекула являє собою правильний плаский шестикутник. Усі зв’язки C - C однакові, а їх довжина не відповідає ні ординарному, ні подвійному зв’язку. Кути між зв’язками дорівнюють 120°.
Атоми Карбону в молекулі бензену знаходяться у стані sp2-гібридизації, кожен атом утворює три о-зв’язки й надає одну р-орбіталь для утворення сполученої системи із шести п-електронів.
Тому структурну формулу бензену зображують так:

Фізичні властивості бензену
Рідина, без кольору, із запахом, tпл = 5,5 °С, tкип = 80 °С, не розчиняється у воді, сам є чудовим неполярним розчинником.
Хімічні властивості бензену
а) Горіння:
C6H6 + 7,5O2 6CO2 + 3H2O + Q (кіптяве полум’я)
б) Заміщення атомів Гідрогену в бензольному кільці (протікає легше, ніж в алканів):

в) Приєднання (протікає складніше, ніж в алкенів):

Застосування бензену та його гомологів
✵ Отрутохімікати
✵ Розчинники
✵ Вибухові речовини
✵ Добавки до пального
✵ Органічний синтез, наприклад, одержання аніліну, фенолу, стиролу й полістиролу, лікарських препаратів
Домашнє завдання: переглянути матеріали підручника , сайту, відео.
Група атомів, що повторюється — структурна ланка.
- легкі;
- міцні;
- стійкі до стирання;
- водо- та газонепроникні;
- не проводять електричний струм.






Тема: Етилен і ацетилен. Молекулярні та структурні формули,фізичні властивості.
Хімічні властивості алканів,алкенів, алкінів.
Алкени (або етиленові вуглеводні) – вуглеводні із загальною формулою СnН2n, в молекулах яких між атомами Карбону є один подвійний зв’язок.
Щоб дати назву алкенам, у назві відповідного алкану суфікс -ан замінюють на –ен. Алкіни (або ацетиленові вуглеводні) – вуглеводні із загальною формулою СnН2n-2, в молекулах яких між атомами Карбону є один потрійний зв’язок.
Щоб дати назву алкінам, у назві відповідного алкану суфікс -ан замінюють на –ин або –ін. Будова молекул етилену і ацетилену Ознака Етилен (алкен) Ацетилен (алкін)
Особливості будови Має 1 подвійний зв’язок С=С Має 1 потрійний зв’язок -С≡ СМолекулярна формула С2Н4 С2Н2 Електронна формула Н:С:::С:Н Структурна формула Н Н С=С Н Н Н – С ≡ С - Н Порівняння будови алканів, алкенів, алкінів Алкани (етан) Алкени (етен) Алкіни (етин)
1. Структурні формули Н Н | | Н – С - С – Н | | Н Н Н Н С=С Н Н Н – С ≡ С - Н
2.Тип гібридизації в атомах С SP3 SP2 SP
3. Кількість гібридних хмар 4 3 2
4.Кут між осями гібридних хмар 109,5º (109,28) 120 º 180 º
5.Зв’зки між атомами С Лише σ зв’язки 1 σ і 1 π 1 σ і 2 π 6.Відстань між атомами С 0,154 нм 0,134 нм 0,120 нм
Фізичні властивості етилену і ацетилену 1. Гази – прозорі. Безбарвні 2. Майже без запаху (С2Н4 слабкий солодкуватий запах) 3. Малорозчинні у воді 4. Легші за повітря : М(С2Н4) = 28 г/моль М (С2Н2) = 26 г/моль М(повітря) = 29 г/моль
https://www.youtube.com/watch?v=Gkr6I6F9u20
Хімічні властивості алкенів та алкінів.
І. Реакції окиснення
1) Горіння або повне окиснення – Карбон швидко згорає (етан горить безбарвним полум’ям). У етану масова частка Карбону більша, тому перед тим як згоріти Карбон розжарюється (ми бачимо світне полум’я). У ацетилена масова частка Карбону найбільша, тому Карбон не весь згорає із-за нестачі кисню (ми бачимо кіптяве полум’я).
2) Часткове окиснення
КMnO4
С2Н4 + Н2О + О → CH2 – CH2
| |
OH OH
Якісна реакція на кратний зв’язок. Фіолетовий колір калій перманганату знебарвлюється.
ІІ. Реакції приєднання
1) Приєднання водню ( гідрування, гідрогенізація)
К
СН2 = СН2 + Н2 → СН3 – СН3
етен етан
К
СН ≡ СН + Н2 → СН2 = СН2
ацетилен етен
К
СН ≡ СН + 2 Н2 → СН3 – СН3
ацетилен етан
2) Приєднання галогенів (галогенування)
СН2 = СН2 + Br2 → СН2Br – СН2Br
СН ≡ СН + Br2 → СН2 Br = СН2 Br
СН ≡ СН + 2Br2→ СНBr2 – СНBr2
Якісна реакція на кратний зв’язок. Бурий колір брому знебарвлюється.
3) Приєднання галогеноводнів (гідрогалогенування, гідроген галогенування)
СН2 = СН2 + НBr → СН3 – СН2Br
СН ≡ СН + НBr → СН2 = СНBr
4) Приєднання води (гідратація)
СН2 = СН2 + Н2О → СН3 – СН2ОН
Добування етилену і ацетилену.
- Дегідрування алканів (відщеплення водню)
к
С2Н6 → С2Н4 + Н2
к
С2Н6 → С2Н2 + 2Н2
- Етилен добувають нагріванням етилового спирту з Н2SO4 конц - дегідратація
Н2SO4
С2Н5ОН → С2Н4 + Н2O
Порівняльна характеристика хімічних властивостей етену та етину

Гомологи метану, склад і будова. Крім метану, у природному газі, супутних нафтових газах наявні речовини, що містять у своєму складі два елементи — Карбон і Гідроген. Вони, як і метан, є насиченими. Групу насичених вуглеводнів, за міжнародною номенклатурою, називають алканами. Подібні за будовою та властивостями насичені вуглеводні отримали назву «гомологи метану». Власне слово «гомолог» означає «подібний». Отже, речовини, про які йтиметься, за складом і властивостями є гомологами метану.
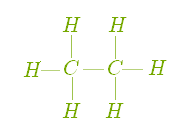
Представником ряду метану є насичений вуглеводень — етан, хімічний склад якого виражає формула С2Н6. Звернемося до демонстрації моделі молекули, щоб краще усвідомити утворення хімічних зв'язків у молекулі етану (рис. )

Рис. Кулестержнева модель молекули етану (а) та її електронна формула (б)

Рис. Масштабна модель молекули етану (а) та її структурна формула (б)
Отже, у молекулі етану, порівняно з молекулою метану, на один атом Карбону та два атоми Гідрогену більше, тобто відмінність полягає в кількості атомів на групу —СН2—.
Будову молекули можна розглядати як молекулу метану, у якій атом Гідрогену заміщений на групу атомів —СН3.
Наступний представник цього ряду — пропан-С3Н8. Розглянемо моделі молекули пропану (рис.).

Рис. Кулестержнева модель молекули пропану

Рис. Масштабна модель молекули пропану
Порівняно з молекулою етану в молекулі пропану на одну групу атомів —СН2— більше. Тому електронна та структурна формули пропану такі:

Розглянувши просторове розміщення атомів у молекулах, поданих моделями, бачимо, що валентний кут не змінився. Як і в метану, утворення хімічних зв'язків між атомами Карбону та Карбону й Гідрогену відбувається в напрямі до вершин тетраедра. Відповідно карбоновий ланцюг має не лінійну, а зигзагоподібну будову. Довжина зв'язків між атомами Карбону становить 0,154 нм.
Мабуть, ви здогадалися, що бутан С4Н10 теж різниться за складом молекули від попереднього представника алканів на групу атомів —СН2—. Цю групу називають гомологічною різницею. Ряд сполук, що різняться за складом на гомологічну різницю, називають гомологічним рядом. Отже, кожний наступний представник гомологічного ряду матиме на одну групу атомів —СН2— більше у своєму складі порівняно з попереднім представником.
Гомологи — це сполуки, що подібні за будовою молекул і хімічними властивостями, але відрізняються за складом молекул на одну або кілька груп атомів —СН2—.
Якщо в структурній формулі не показувати зв'язки між атомами Карбону та Гідрогену, то утворюється скорочена структурна формула. Скорочені формули для етану та пропану подані нижче:

Назви, молекулярні та скорочені структурні формули перших десяти гомологів насичених вуглеводнів, їхній агрегатний стан, температури кипіння та плавлення наведено в таблиці .
Таблиця
Вуглеводні гомологічного ряду метану (насичені вуглеводні)
Вуглеводень | Молекулярна формула | Скорочена структурна формула | Агрегатний стан | t°кип. (°C) | t°плавл. (°C) |
Метан | СН4 | СН4 | Гази за нормальних умов | -161,5 | -183 |
Етан | С2Н6 | СН3—СН3 | -88,6 | -172 | |
Пропан | С3Н8 | СН3—СН2—СН3 | -42 | -188 | |
Бутан | С4Н10 | СН3—СН2—СН2—СН3 | -0,5 | -135 | |
Пентан | С5Н12 | СН3—СН2—СН2—СН2—СН3 | Рідини | 36,1 | -130 |
Гексан | С6Н14 | СН3—(СН2)4—СН3 | 68,7 | -95 | |
Гептан | С7Н16 | СН3—(СН2)5—СН3 | 98,4 | -91 | |
Октан | С8Н18 | СН3—(СН2)6—СН3 | 125, 7 | -57 | |
Нонан | С9Н20 | СН3—(СН2)7—СН3 | 150,8 | -54 | |
Декан | С10H22 | СН3—(СН2)8—СН3 | 174,1 | -30 | |
Назви перших чотирьох склалися історично. Починаючи з пентану, назви походять від грецьких числівників з додаванням суфікса -ан. | Починаючи з С16H34, тверді речовини | Температури кипіння та плавлення зростають | |||
Загальна формула — CnH2n+2 | |||||
Отже, метан утворює гомологічний ряд насичених вуглеводнів. За складом кожний наступний представник цього ряду різниться від попереднього на групу атомів —СН2—. Загальна формула — CnH2n+2, де n — кількість атомів Карбону; відповідно можна обчислити кількість атомів Гідрогену.
• Напишіть самостійно, користуючись загальною формулою, формули гомологів метану, до складу яких входять: а) 6 і 8 атомів Карбону; б) 30 і 36 атомів Гідрогену.
Фізичні властивості. Фізичні властивості насичених вуглеводнів наведено в таблиці . Із збільшенням відносної молекулярної маси зростають температури кипіння, плавлення та густина.
З таблиці видно, що температури кипіння та плавлення є низькими порівняно з неорганічними речовинами. Це пояснюється тим, що органічні речовини, зокрема алкани, — сполуки молекулярної будови. З неорганічної хімії вам відомо, що зв'язки між молекулами утворюються на основі міжмолекулярних сил і є досить слабкими. Тому під час нагрівання вони швидко руйнуються.
Гомологи метану, починаючи з пентану, мають характерні запахи. Вони нерозчинні у воді й інших полярних розчинниках.
З підвищенням тиску пропан і бутан легко скраплюються.
Лабораторний дослід
Виготовлення моделей молекул вуглеводнів
Завдання. Виготовте моделі молекул етану, пропану, бутану, пентану. Розгляньте просторове розміщення атомів Карбону та Гідрогену. Зробіть відповідні висновки.
Обладнання: пластилін або заготовлені вдома кульки з пластиліну чорного та білого кольорів; сірники. Якщо наявні набори для складання моделей, використайте їх.
Хід роботи
1. Виготовте з пластиліну кульки: п'ять чорного кольору та дванадцять — білого або іншого світлого кольору (за відсутності білого). Кульки чорного кольору, що моделюють атоми Карбону, мають бути приблизно в 1,5 раза більші за білі кульки — моделі атомів Гідрогену.
2. Визначте, у яких точках треба вставити сірники, щоб кут між ними становив 109,5°, тобто щоб «орбіталі» валентних електронів були спрямовані до вершин тетраедра.
3. З'єднайте дві кульки — моделі атомів Карбону й приєднайте до них шість кульок — моделі атомів Гідрогену в тетраедричному напрямі. Порівняйте вашу модель з кулестержневою моделлю молекули етану (див. рис. ). Намалюйте свою модель.
4. Нарощуйте карбоновий ланцюг. Зніміть один атом Гідрогену в моделі молекули етану й додайте групу атомів —СН3, у якій усі атоми розміщені тетраедрично. Ви отримаєте модель молекули пропану. Порівняйте її з кулестержневою моделлю молекули пропану (див. рис.). Намалюйте модель.
5. Нарощуйте карбоновий ланцюг так само, як описано в п. 4. У вас утворяться моделі молекул бутану й пентану. Намалюйте їх і зверніть увагу на будову карбонового ланцюга. Як розміщені атоми в просторі?
6. Спробуйте змінити просторову форму моделі молекули пентану, обернувши навколо зв'язків С-С групи атомів —СН3. Ви отримаєте дві моделі просторових форм молекули пентану, крім тої, що ви виготовили.
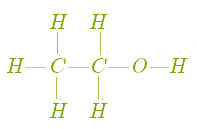
1. Молекулярні формули показують, скільки і яких атомів міститься у молекулі речовини. Молекулярні формули етану і етанолу записуються наступним чином:
Риска, що сполучає два атоми, позначає валентність. Чотири рисочки у символі Карбону в молекулах етану і етанолу позначають його чотиривалентність і показують число хімічних зв'язків з іншими атомами. Дві рисочки у символі Оксигену показують, що він є двохвалентним, а одна риска біля символу Гідрогену говорить про те, що цей елемент є одновалентним.
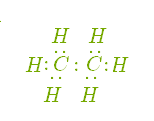
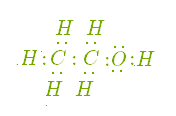
Вуглеводні. Таку загальну назву мають сполуки, від яких походять усі органічні речовини. Слово «вуглеводень» складається із частини загальної назви простих речовин Карбону — «вуглець» — і назви простої речовини Гідрогену — «водень».
Вуглеводні — сполуки Карбону з Гідрогеном.
Вуглеводні
CnHm
Загальна формула вуглеводнів — СnНm.
Вуглеводні, в молекулах яких атоми Карбону сполучені між собою простим ковалентним зв'язком, називають насиченими. Таку назву речовинам надано тому, що кожний атом Карбону в їхніх молекулах сполучений із максимально можливою кількістю атомів Гідрогену.
• Складіть формули насичених вуглеводнів з одним і двома атомами Карбону в молекулах.
Крім насичених вуглеводнів, існують ненасичені вуглеводні. У молекулах цих сполук атоми Карбону сполучені між собою не лише простим, а й подвійним, потрійним ковалентними зв'язками.
• Складіть формули ненасичених вуглеводнів із двома атомами Карбону в молекулах.
Вуглеводні дуже поширені в природі; з них майже повністю складаються нафта і природний газ. Ці сполуки слугують паливом, завдяки якому люди забезпечують себе теплом і світлом. Їх використовують як пальне для автомобілів, літаків, кораблів, як сировину для виробництва полімерних матеріалів, засобів захисту рослин, товарів побутової хімії, ліків тощо.
Метан. Найпростішим насиченим вуглеводнем є метан СН4. Це — головний компонент природного газу.
У молекулі метану, як і в молекулах інших органічних сполук, атом Карбону чотиривалентний. Для того щоб виявляти таку валентність, він повинен мати чотири неспарені електрони. Це досягається внаслідок так званого збудження атома після отримання ним додаткової енергії й переходу одного електрона із 2s-орбіталі у вільну 2p-орбіталь:

У кожній зовнішній орбіталі збудженого атома Карбону розміщується один електрон.
За рахунок чотирьох неспарених електронів атома Карбону й електронів чотирьох атомів Гідрогену в молекулі СН4 утворюються чотири спільні електронні пари:

Наведені формули не відображають просторової будови молекули метану. Згідно з ними всі атоми в молекулі СН4 мають перебувати в одній площині, а кути між сусідніми рисками-зв'язками — дорівнювати 90°. Але насправді це не так.
• Пригадайте, які форми мають s- і p-орбіталі. Як зорієнтовані в просторі три 2р-орбіталі одного атома?
Розглянемо, як утворюються чотири прості ковалентні зв'язки С-Н у молекулі СН4.
При утворенні молекули метану з атомів 2s-орбіталь і три 2p-орбіталі атома Карбону (мал. 44) перетворюються на чотири однакові орбіталі, які мають вигляд об'ємних несиметричних вісімок (мал. 45). Вони розміщуються у тривимірному просторі й перебувають на однаковій віддалі одна від одної під кутами 109,5° (мал. 46).

Мал. 44. 2s-орбіталь і три 2р-орбіталі в атомі Карбону

Мал. 45. Зміна форм зовнішніх орбіталей атома Карбону
Більша «пелюстка» кожної нової орбіталі атома Карбону перекривається зі сферичною орбіталлю атома Гідрогену. Крізь ділянку перекривання проходить лінія, яка з'єднує центри цих атомів.
Якщо з'єднати лініями центри всіх атомів Гідрогену, отримаємо геометричну фігуру — тетраедр1 (мал. 46). Тому кажуть, що молекула метану має тетраедричну будову.
1 Слово походить від грецьких слів tetra — чотири і hedra — поверхня. Тетраедр має чотири однакові грані, які є правильними трикутниками.

Мал. 46. Розміщення орбіталей у молекулі метану
Моделі молекули2 метану зображено на малюнку 47. (Особливості кулестержневої та масштабної моделей описано в § 2.)
2 Існують комп'ютерні програми, за допомогою яких можна створити модель будь-якої молекули.

Мал. 47. Моделі молекули метану: а — кулестержнева; б — масштабна. Білі кульки — атоми Гідрогену, чорні — атоми Карбону
Оскільки електронегативності Карбону й Гідрогену різняться мало, то ковалентний зв'язок С-Н є малополярним. Однак сама молекула СН4 неполярна, бо на її «поверхні» невеликий позитивний заряд розподілений рівномірно. Цим молекула метану відрізняється від полярної молекули води
Д.З.Опрацювати матеріали підручника п. 27, сайту,
Протонне число Карбону збігається з його порядковим номером у періодичній системі і дорівнює шести. Позитивний заряд шести проте - у ядрі атома Карбону компенсується негативним зарядом шести електронів його електронної оболонки. Карбон - елемент ІVА-підгрупи періодичної системи, тому на зовнішньому (другому) енергетичному рівні його атома містяться чотири електрони. В основному стані - лік спарені s- і два неспарені р-електрони.
Під час хімічних реакцій атом Карбону переходить у так званий зближений стан. Унаслідок цього один з 2s-електронів, поглинувши порцію, енергії, займає вільну 2р-орбіталь, усі чотири електрони зовнішнього рівня стають неспареними.
Тому валентність IV властива атомам Карбону в збудженому стані В органічних сполуках кристалічні ґратки переважно молекулярні, тож вони мають невисокі температури плавлення та кипіння й менш термостійкі порівняно з неорганічними.
Особливості будови органічних сполук позначаються й на їхніх хімічних властивостях. Реакції за участю органічних сполук часто оборотні, проходять досить повільно, у кількох напрямах і у кілька стадій та супроводжуються утворенням побічних продуктів.
• Структурні формули органічних речовин - знакові моделі, у яких символи хімічних елементів сполучені рисочками, кількість яких відповідає валентності атома цього елемента в сполуці
Це означає, що під час перебігу цих реакцій відбувається не тільки обмін атомами, йонами або групами атомів, а й обмін електронами, який і веде до зміни ступеня окиснення елементів.
Окисно-відновні реакції найпоширеніші в природі. З їх допомогою на виробництві одержують багато хімічних речовин (амоніак, луги, кислоти). До окисно-відновних реакцій належать процеси горіння, дихання, фотосинтезу й багато інших. Характерна риса цих процесів — зміна ступеня окиснення елементів у речовинах, які беруть участь у реакції.

Розглянемо приклад іншої реакції:
![]()
Це окисно-відновна реакція, під час її перебігу ступінь окиснення Гідрогену й Брому змінився.
У Гідрогену ступінь окиснення дорівнював нулю, а став +1, у Брому також ступінь окиснення дорівнював нулю, а став -1.
• Зміна ступеня окиснення атомів або йонів — головна ознака окисно-відновних реакцій.
Завдання. Давайте згадаємо, як визначати ступені окиснення. Визначте ступені окиснення всіх елементів у речовинах: BaSO4, FeCl3, H2, Ca(NO3)2, Fe2(SO4)3.
ПРОЦЕСИ ОКИСНЕННЯ Й ВІДНОВЛЕННЯ. ОКИСНИКИ Й ВІДНОВНИКИ
В окисно-відновних реакціях ступені окиснення елементів змінюються, тому що у процесі взаємодії речовин одні атоми або йони віддають електрони, а інші їх приймають.
Ці частинки мають свої назви.
Атом або йон, який віддає електрони, називають відновником. Атом або йон, який приймає електрони, називають окисником.
Як змінюється заряд під час приймання або віддачі електронів? Треба пам'ятати, що електрони негативно заряджені. Тому:
• Якщо частинка віддає електрони, то її заряд підвищується, якщо приймає — заряд знижується.


— Як же запам'ятати, що окисник, а що відновник?
— Можна так: «відновник — віддає», обидва слова на літеру «в».
— А я так придумав: відновлює мої кишенькові гроші мама, вона мені їх віддає, значить, вона — відновник!
— Ну, тоді ти — окисник: ти ж забираєш гроші — електрони.
Процеси віддачі або приймання електронів теж мають свої назви.
Окиснення — це процес віддачі електронів атомом, молекулою, йоном. При цьому ступінь окиснення елемента підвищується.
Відновлення — це процес приймання електронів атомом, молекулою, йоном. При цьому ступінь окиснення елемента знижується.
Коли ми говоримо «ступінь окиснення елемента підвищується або знижується», то маємо на увазі його алгебраїчне значення, тобто враховуємо знак, який стоїть перед числом.
• Запам'ятайте, що, якщо частинка окиснюється, вона — відновник, якщо відновлюється — окисник.
Наприклад:
Na0 - 1e → Na+
Na0 — відновник, процес — окиснення;
Cl02 + 2e → 2Cl-
Треба зазначити, що, якщо в молекулі або формульній одиниці речовини є атоми, які віддають електрони внаслідок хімічної взаємодії, тобто відновники, то й усю речовину часто називають відновником. Якщо в складі речовини є атоми, які приймають електрони, тобто окисники, то й усю речовину називають окисником. Це не зовсім точно, але така вже у хіміків існує традиція. Наприклад, у калій перманганаті Mn+7 — окисник, тому KMnO4 вважають речовиною-окисником.
Підсумок:

Що ж є причиною зміни ступенів окиснення елементів під час окисно-відновних реакцій? Така зміна відбувається внаслідок переходу електронів від одних частинок атома до інших або зміщення електронної густини між атомами реагентів реакції.
В окисно-відновних реакціях одночасно відбуваються два взаємопов’язані процеси: окиснення та відновлення.
Окиснення — це процес, під час якого частинки реагентів реакції віддають електрони.
Відновлення — процес приєднання електронів частинками реагентів.
Розглянемо ці процеси на прикладі реакції взаємодії алюмінію з хлором:
![]()
Внаслідок реакції ступінь окиснення Алюмінію змінився з 0 до +3, тобто атом Алюмінію віддав 3 електрони. Цей процес записують таким електронним рівнянням:
![]()
Отже, відбувся процес окиснення.
Ці 3 електрони перейшли до Хлору, де кожний атом приєднав по одному з них, і Хлор набув ступінь окиснення -1.
Отже, згідно з електронним рівнянням
![]()
відбувся процес відновлення (молекула Хлору приймає 2 електрони).
Важливо зазначити, що процес окиснення завжди супроводжується процесом відновлення. Атоми, молекули чи йони, які віддають електрони, називають відновниками. Атоми, молекули або йони, які приєднують електрони, називають окисниками.
Оскільки під час окисно-відновних реакцій відбуваються 2 процеси одночасно, кількість електронів, що віддає відновник, завжди дорівнює кількості електронів, які приєднує окисник.
Ураховуючи це правило, у реакції між алюмінієм і хлором необхідно дібрати коефіцієнти.
Метод електронного балансу. Цей метод застосовують для добору коефіцієнтів в окисно-відновних реакціях.
Щоб скласти рівняння реакції на основі електронного балансу, після запису молекулярного рівняння треба записати електронні рівняння.
1. Повторюємо їхній запис:

2. Проводимо вертикальну риску й виписуємо за нею кількість електронів, що віддали й приєднали атоми Алюмінію та Хлору.
3. Визначаємо найменше спільне кратне для чисел 3 і 2. Це число б, яке записуємо за другою вертикальною рискою посередині.
4. Ділимо найменше спільне кратне почергово на 3 і 2 й записуємо результат за третьою рискою в рядках, що стосуються елементів Алюмінію та Хлору. Ці числа відповідають коефіцієнтам. У молекулярному рівнянні перед алюмінієм (відновником) ставимо коефіцієнт 2, а перед хлором (окисником) — 3. Добираємо коефіцієнт для алюміній хлориду. Він становить 2. Правильно записане рівняння:
2Аl + 3Сl2 = 2АlСl3.
Розглянемо ще один приклад окисно-відновної реакції та складемо електронний баланс:

Біля гідроген сульфіду (відновника) ставимо коефіцієнт 2, а біля кисню (окисника) — 3.
У правій частині молекулярного рівняння поставимо коефіцієнти так, щоб їхнє числове значення відповідало кількості атомів у лівій частині рівняння.
Отже, рівняння окисно-відновної реакції має такий вигляд:
2H2S + 3О2 = 2SO2 + 2Н2О.
Відновниками в окисно-відновних реакціях є атоми металічних елементів (Na, К, Mg, Zn, Al), неметали (H2,С ), йони безоксигенових кислот Сl-, Вr-, I-, а також йони металічних елементів із нижчими ступенями окиснення:
![]()
До окисників належать кисень, хлор, бром, йод, сірка, нітратна й сульфатна кислоти тощо.
Якщо під час реакції теплота виділяється, то реакційна суміш розігрівається. Екзотермічними є всі реакції горіння та багато інших реакцій. Наприклад, під час гасіння вапна (взаємодії кальцій оксиду з водою) виділяється так багато теплоти, що вода може закипіти й розпушити тверду речовину. Через це кальцій гідроксид також називають «пушонкою»
CaO + H2O = Cа(OH)2
Багато теплоти виділяється також під час реакцій за участі хімічно активних речовин — галогенів, лужних металів тощо.
Деякі екзотермічні реакції не починаються одразу після змішування (початку контактування) реагентів. Наприклад, дерева завжди контактують з киснем (у повітрі), але не займаються. Для того щоб почалося горіння, необхідно підігріти деревину, тобто ініціювати реакцію. Після ініціації горіння само себе «підтримує» й не закінчиться, поки не припиниться доступ кисню або вся деревина не згорить.
Хімічні реакції, у результаті яких відбувається поглинання теплоти, називають ендотермічними.
До ендотермічних реакцій належать більшість реакцій розкладу, наприклад розкладання кальцій карбонату:
СаСО3(тв.) = СаО(тв.) + СO2(г.)

Більшість ендотермічних реакцій необхідно постійно підтримувати, зазвичай нагріванням. Наприклад, щоб почалося розкладання кальцій карбонату (вапняку), його необхідно нагріти до температури близько 1100 °С та постійно її підтримувати. Під час ендотермічної реакції теплота поглинається, і якщо припинити нагрівання — реакція зупиниться.
Існують хімічні реакції, в яких енергія виділяється у вигляді світла. Найпоширенішою такою реакцією є горіння. Але є й інші. Так, у разі зберігання білого фосфору на повітрі він одразу починає реагувати з киснем. Частина енергії під час цієї реакції виділяється у вигляді світла, тому білий фосфор світиться в темряві. Це явище називають хемілюмінесценцією. Саме воно є інтригою детективу «Собака Баскервілів» сера А. Конан Дойла.
Явище хемілюмінесценції притаманне й живим організмам: хімічні реакції забезпечують світіння в темряві світлячків, деяких медуз тощо. До речі, хемілюмінесценція дуже поширена серед рослин і тварин у фантастичному світі з кінофільму «Аватар».
Існують хімічні реакції, що відбуваються з поглинанням світла. Їх називають фотохімічними. Найвідоміша фотохімічна реакція — це фотосинтез. Також під дією світла відбувається перетворення кисню на озон. Речовини-барвники, якими забарвлений наш одяг, поглинають світло й перетворюються на безбарвні речовини, через що одяг із часом вицвітає. А в деяких окулярах містяться фотохромні лінзи, завдяки яким такі окуляри всередині помешкання безбарвні, а за сонячного освітлення стають темними. У фотохімічних процесах беруть участь особливі молекули на сітківці нашого ока, завдяки чому ми бачимо.

Білий фосфор на повітрі в темряві

Світіння світлячків

Світіння мешканців океанських глибин
Рідко трапляються ендотермічні реакції, що відбуваються за звичайних умов. Їх легко розпізнати, оскільки спостерігається охолодження реакційної суміші. Наприклад, під час взаємодії барій гідроксиду з амоній нітратом реакційна суміш замерзає, а посудина покривається краплинами води й навіть може примерзнути до підставки (мал. 18.2):
Ba(OH)2 + 2NH4NO3 = Ba(NO3)2 + 2NH3↑ +2H2O
Ентальпію речовини ще називають її «тепловим вмістом», оскільки вона показує, скільки теплоти «запасено» в речовині. Ентальпію позначають літерою H. У системі СІ одиницею вимірювання ентальпії є Дж/моль (кДж/моль), але до сьогодні її ще вимірюють у застарілих одиницях — калоріях.

Виміряти ентальпію речовини неможливо, тому на практиці використовують величину, що характеризує зміну ентальпії під час певних процесів — ΔΗ. Кількість теплоти, що виділяється або поглинається під час взаємодії (тобто ΔΗ), можна визначити експериментально. Зміна ентальпії в реакційній суміші під час хімічних реакцій становить тепловий ефект хімічної реакції.
Тепловий ефект реакції ΔΗ — це різниця між ентальпією продуктів реакції та ентальпією реагентів:
ΔH(реакції) = Н(продуктів реакції) - Н(реагентів)
- утворення нерозчинної речовини (осаду):
- утворення летких або газоподібних речовин:
- утворення малодисоційованих речовин
Довкола нас, в природі, в людському організмі, в організмах рослин і тварин, на виробництвах відбувається безліч хімічних реакцій. З накопиченням відомостей про реакції встало питання про їх класифікацію. Речовини класифікують за кількома ознаками. Найважливіші з них:
- число і склад реагентів і продуктів реакції;
- зміна або незмінність міри окислення елементів в результаті реакції;
- виділення або поглинання теплоти під час реакції;
- можливі напрями протікання реакції;
- у присутності каталізатора або без нього.
За першою ознакою реакції поділяються на чотири типи:
- З'єднання.
- Розклад.
- Сполучення.
- Обмін.
А + В = АВ
- між простими речовинами
- між складними речовинами
а) основний оксид з водою
б) кислотний оксид з водою
в) між основними і кислотними оксидами
Реакція, в результаті якої з однієї речовини утворюється декілька речовин, називають реакцією розкладу.
А В = А + В
Розклад меркурій (ІІ) оксиду |
Наприклад:
- нерозчинні основи
- амфотерні гідроксиди
- оксигенномісткі кислоти
- солі
- оксиди
Реакції розкладання відбуваються, як правило, при нагріванні.
Не розкладаються при нагріванні гідроксиди, карбонати, сульфати Натрію і Калію, а також утворені двома нелеткими оксидами.
Реакція між простою і складною речовиною, в результаті якої утворюються інші проста і складна речовини, називають реакцією заміщення.
А+ВС=В+АС
Реакція алюмінію з водним розчином лугу |
- за участю неметалів
Реакцію між двома складними речовинами, в результаті якої вони обмінюються своїми складовими(атомами, групами атомів, іонами), називають реакцією обміну.
АВ +СD = АD +CB
Реакції обміну відбуваються переважно у водному розчині. У них беруть участь електроліти : кислоти, підстави, солі.
Осадження кадмій сульфіду |
Ці реакції можливі:
- якщо утворюється осад
- якщо виділяється газ
- з утворенням слабкого електроліту
Швидкість хімічних реакцій залежить від багатьох чинників, серед яких п’ять основних: природа реагуючих речовин, їхня температура, концентрація, ступінь подрібненості й наявність каталізатора.
1. Природа реагуючих речовин. Швидкість хімічних реакцій залежить від хімічного складу речовин, густини, радіуса атома, типу хімічного зв’язку, кристалічної ґратки.
Так, хлоридна кислота миттєво взаємодіє з аргентум нітратом, бурхливо реагує з магнієм, активно – із цинком і не взаємодіє з міддю.
2. Ступінь подрібнення речовин, які реагують. Якщо речовина подрібнена, то збільшується поверхня стикання речовин і швидкість реакції між ними зростає. Швидкість реакції прямо пропорційна площі речовин, що реагують.
3. Концентрація речовин, що реагують. Чим більше частинок реагуючих речовин міститься в одиниці об’єму, тим частіше відбуваються зіткнення між ними і вищою є швидкість реакції (хоч і не кожне зіткнення спричиняє взаємодію). Норвезькі вчені К. Гульдберг та П. Вааге сформулювали закон діючих мас для реакції, яка відбувається внаслідок попарних зіткнень між молекулами.
Для газоподібних речовин на швидкість реакцій впливає тиск. З підвищенням тиску швидкість реакції збільшується.
4. Температура речовин, що реагують. За правилом Вант-Гоффа підвищення температури на кожні 10ºC спричиняє зростання швидкості більшості реакцій у 2-4 рази. Це пояснюється тим, що нагрівання речовин сприяє збільшенню числа активних молекул, які вступають у хімічну взаємодію, оскільки мають достатню енергію для здійснення реакції.
5. Наявність каталізатора. Нагадаємо, що каталізатори – це речовини, які прискорюють хімічні реакції, а самі не входять до продуктів реакції. Виявляється, що каталізатор бере участь у реакції, утворюючи з вихідними речовинами проміжні продукти, які швидко руйнуються, і каталізатор вивільняється з них.
Реакції, що відбуваються за наявності каталізаторів, називаються каталітичними, а сам процес зміни швидкості реакції під впливом каталізатора – каталізом.
Каталізатори можна поділити на такі групи:
а) позитивні (прискорюють хімічні реакції). Розклад бертолетової солі під час нагрівання відбувається дуже повільно, але варто додати лише кілька крупинок каталізатора MnO2 й реакція відбувається бурхливо;
б) негативні, або інгібітори (сповільнюють хімічні реакції). Відомі інгібітори корозії. Якщо додавати уротропін, наприклад, до хлоридної кислоти, то розчинення заліза в ній значно зменшується або практично припиняється;
в) біокаталізатори – каталізатори білкової природи (ферменти), які прискорюють біохімічні процеси в живих організмах – дихання, травлення, фотосинтез.
Каталізатор може змінювати не лише швидкість хімічної реакції, але й її механізм. Специфічні каталізатори прискорюють одну реакцію, а для іншої бувають неефективними. Універсальні каталізатори змінюють швидкість різних реакцій.
Каталіз широко використовують у багатьох технологічних процесах, особливо в хімічній промисловості: виробництві амоніаку, сульфатної та нітратної кислот, барвників, у синтезі полімерів, синтетичного каучуку тощо.
- реакцій сполучення:
2H2+O2=2H2O ;
- реакції розкладу:
CaCO3=t°CaO+CO2↑⏐⏐ ;
- реакції заміщення:
Zn+H2SO4=ZnSO4+H2↑ ;
- реакції обміну:
Na2SO4+BaCl2=2NaCl+BaSO4↓ .
- окисно-відновні реакції:
S0+O20=S+4O2−2 ;
- реакції йонного обміну:
Ag++Cl−=AgCl⏐↓ .
- екзотермічні реакції:
CH4+2O2=CO2↑+H2O+Q ;
- ендотермічні реакції:
BaCO3=BaO+CO2↑−Q .
- оборотні реакції:
Ca(OH)2⇄CaO+H2O ;
- необоротні реакції
P2O5+3H2O=2H3PO4 .Проаналізуємо, яка кількість простих і складних речовин вступили в реакцію і скільки їх утворилося в результаті реакції.- У першій реакції з двох простих речовин утворилася одна складна, що складається з двох елементів.
- У другий — з двох складних речовин, кожна з яких складалося з двох елементів, утворилася одна складна речовина, що складається вже з трьох елементів.
Реакції сполучення — це такі реакції, у результаті яких з одної або декількох вихідних речовин утворюється одна складна речовина.- При розкладанні калій перманганату (марганцівки) утворюються дві складні речовини і одна проста:
2KMnO4−→−t°K2MnO4+MnO2+O2↑⏐⏐⏐ .Реакції розкладу — це реакції, у результаті яких з одної складної речовини утворюються дві або більше нових речовин.- При взаємодії ферум(
III ) оксиду з алюмінієм, утворюються алюміній оксид і залізо:
Fe2O3+2Al=t°Al2O3+2Fe .У розглянутих випадках з одної складної речовини і одної простої речовини у результаті реакцій утворилися дві нові речовини —одна складна і одна проста.При цьому атоми простої речовини заміщають атоми одного з хімічних елементів у складній речовині.Реакції заміщення — це реакції, у результаті яких атоми простої речовини заміщають атоми одного з хімічних елементів у складній речовині.H2SO4+2NaOH=Na2SO4+2H2O - При взаємодії ферум(
ЙОННІ РІВНЯННЯ РЕАКЦІЙ
Змішуючи розчини речовин, ми маємо розуміти, що по суті в хімічну взаємодію будуть вступати йони, на які ці речовини дисоціювали. Тому, враховуючи дисоціацію електролітів у розчинах, рівняння багатьох реакцій можна записати в йонній формі. Таку форму запису називають йонним рівнянням реакції.
Йонне рівняння показує, які саме йони беруть участь у реакції.
Наприклад, змішаємо розчини арґентум(І) нітрату й натрій хлориду. Обидві солі розчинні, отже, вони присутні в розчині у вигляді йонів, а в результаті реакції утворюється нерозчинна речовина AgCl — на йони вона не розпадається.
AgNO3 + NaCl = AgCl↓ + NaNO3
Запишемо, які йони ми змішали, зливши разом розчини, складемо рівняння:
Ag+ + NO-3 + Na+ + Cl- = AgCl↓ + Na+ + NO-3
От це рівняння й називається йонним. Оскільки тут представлені всі йони, то його називають повним йонним рівнянням.
Суть реакції полягає в утворенні осаду AgCl внаслідок узаємодії йонів Ag+ і Cl-, тоді як йони Na+ і NO-3 залишаються в розчині й фактично не беруть участі в реакції. Йони, які не брали участі в хімічній реакції, прийнято скорочувати.
![]()
Тоді рівняння набуває такого вигляду:
Ag+ + Cl- = AgCl↓
Таке рівняння називають скороченим йонним рівнянням.
Йонні рівняння можна записувати до будь-яких хімічних реакцій, у яких беруть участь водні розчини речовин. Найповніше вони описують хімічні взаємодії, які належать до реакцій обміну.
Реакції йонного обміну — це реакції між йонами, які утворилися в результаті дисоціації електролітів.
• Складаючи йонні рівняння реакцій, не забувайте після запису хімічного рівняння:
1. Визначити, які речовини дисоціюють, а які — ні.
- Нерозчинні у воді сполуки (у таблиці розчинності вони позначені літерою «н») майже не дисоціюють.*
- Також дисоціації не піддаються гази.
* Речовини, позначені в таблиці розчинності як нерозчинні, дисоціюють, але в дуже малому ступені. Тому під час запису йонних рівнянь їх дисоціацією нехтують.
Приблизно на 556 000 000 недисоційованих молекул води дисоціює тільки 1 молекула.
- Не записують у йонних рівняннях реакцій і дисоціацію води, тому що це речовина, яка дисоціює в незначній кількості.
- Якщо в таблиці розчинності в клітинці стоїть літера «р», то речовина, утворена цими йонами, дисоціює.
— Я вам ще скажу, що не треба писати дисоціацію простих речовин (не зрозуміло, на що вони взагалі можуть дисоціювати) і оксидів. Здається, це й так зрозуміло, але в мене у класі деякі учні роблять помилки.
2. Розставити коефіцієнти.
Зверніть увагу, що ми будемо умовно записувати в йонних рівняннях дисоціацію слабких електролітів повністю.
ПОРЯДОК СКЛАДАННЯ ЙОННИХ РІВНЯНЬ РЕАКЦІЇ
Зараз будемо вчитися складати йонні рівняння. Діємо поетапно.
1. Записуємо схему рівняння реакції в молекулярній формі:
H2SO4 + NaOH → Na2SO4 + H2O
2. Розставляємо коефіцієнти в схемі хімічної реакції:
H2SO4 + 2NaOH = Na2SO4 + 2H2O
3. Перевіряємо, чи є серед реагентів або продуктів реакції такі, що мало дисоціюють, речовини, які випадають в осад, або гази. Осади позначаємо стрілкою вниз, гази — стрілкою вгору. У наведеному рівнянні є сполука, що мало дисоціює, — вода, значить, H2O записуємо в молекулярній формі, а інші речовини — у вигляді йонів. Отримуємо повне йонне рівняння:
2H+ + SO2-4 + 2Na+ + 2OH- = 2Na+ + SO2-4 + 2H2O
Увага! Коефіцієнт, який стоїть перед формулою, має відношення до всіх елементів, що входять до складу речовини. Так, коефіцієнт 2 перед NaOH показує, що в реакції бере участь 2 моль речовини, відповідно, під час дисоціації утворюється 2 моль йонів Na+ і 2 моль йонів OH-.
Виключаємо з обох частин йонного рівняння однакові (тобто такі, що не беруть участі в реакції) йони:
![]()
• Переписуємо йони, що залишилися:
2H+ + 2OH- = 2H2O
Скорочуємо коефіцієнти:
H+ + OH- = H2O
Це скорочене йонне рівняння.
4. Малорозчинні речовини (у таблиці розчинності літера «м») можуть бути в розчині й у вигляді йонів, і у вигляді осаду. Як же його записувати?
Як правило, якщо малорозчинна речовина утворюється в результаті реакції, то під час запису йонного рівняння її вважають нерозчинною та, відповідно, у вигляді йонів не записують. Якщо ця речовина вступає в хімічну реакцію, то, залежно від взаємодії, її можна записувати або у вигляді йонів, або в недисоційованому вигляді.
Наприклад, згадайте, що нерозчинні основи не реагують із солями. Тому якщо ви записуєте рівняння реакції взаємодії кальцій гідроксиду з купрум(ІІ) хлоридом і сподіваєтеся одержати купрум(ІІ) гідроксид, то кальцій гідроксид у йонному рівнянні слід записувати у вигляді йонів. У реакції буде брати участь тільки розчинна частина цієї сполуки. Якщо кальцій гідроксид утворюється в результаті реакції, то його враховують як осад.

Зверніть увагу, що для отримання осаду Ca(OH)2потрібні досить значні концентрації реагентів.
Якщо ви хочете з'ясувати, чи правильно ви написали рівняння, то подивіться спочатку на скорочене йонне рівняння: якщо число атомів елементів зліва і справа однакове і сума зарядів йонів зліва дорівнює сумі зарядів йонів справа, то є надія, що правильно записано й повні йонні та молекулярні рівняння. Але перевірити їх також треба.
Суть реакцій обміну в розчинах електролітів полягає у видаленні певних йонів з розчину. Тому йонні реакції на письмі відображають йонними рівняннями, що вказують на ті йони, які взяли участь у реакції. Проведемо демонстраційні досліди.
Дослід 1. Взаємодія лугу з кислотою (реакція нейтралізації).
Наллємо в пробірку розчин натрій гідроксиду, доллємо розчин фенолфталеїну й розчин нітратної кислоти.
• Пригадайте, для чого потрібно під час проведення реакцій нейтралізації до лугу доливати розчин фенолфталеїну.
Під час доливання індикатора забарвлення розчину змінюється на малинове, а при доливанні кислоти розчин знебарвлюється. Це означає, що реакція відбулася. Запишемо молекулярне рівняння:
NaOH + HNO3 = NaNO3 + H2O.
Пам'ятаючи, що й натрій гідроксид, і нітратна кислота є сильними електролітами, запишемо їх дисоціацію на йони:
Na+ + OH- + H+ + NO-3.
Отже, під час змішування цих речовин у їхніх водних розчинах був саме такий набір йонів.
Для завершення складання рівняння реакції проаналізуємо утворені речовини, користуючись таблицею розчинності кислот, основ, амфотерних гідроксидів і солей у воді.
Сіль натрій нітрат є добре розчинною у воді й сильним електролітом. У розчині після реакції залишаються незмінними йони Na+ і NO-3. Отже, у реакції взяли участь йони Н+ і OH-, утворивши малодисоційовані молекули води.
На основі молекулярного рівняння складають повне та скорочене йонні рівняння. У повному записують усі йони до реакції та йони й недисоційовані новоутворені сполуки. Повне йонне рівняння нейтралізації має такий вигляд:
Na+ + OH- + H+ + NO-3 = Na+ +NO-3 + Н2О.
Скоротивши йони, які є до й після реакції, отримаємо скорочене йонне рівняння:
OH- + H+ = Н2О.
Отже, суть реакції нейтралізації, яка належить до реакцій обміну, у водному розчині полягає у взаємодії гідроксид-іонів з йонами Гідрогену з утворенням малодисоційованих молекул води.
Очевидно, що реакції обміну в розчинах електролітів полягають у взаємодії йонів між собою.
Умови перебігу реакцій обміну в розчинах електролітів. Ви вже з'ясували, що в розчинах електролітів основними реагентами є йони, на які ці електроліти розпадаються під час розчинення. Це основна умова перебігу будь-якої реакції обміну, що відбувається в розчині. Однак ви також спостерігали, що під час перебігу реакції нейтралізації утворюється малодисоційована сполука — вода. Це один із трьох випадків перебігу реакцій йонного обміну, бо вода є слабким електролітом.
Проведемо ще один демонстраційний дослід.
Дослід 2. Взаємодія арґентум(І) нітрату з натрій йодидом.
У пробірку з розчином арґентум(І) нітрату доллємо краплями розчин натрій йодиду. Спостерігаємо випадання жовтого осаду. З'ясуємо, які йони взяли участь у реакції:
AgNO3 + NaI = AgI↓ + NaNO3;
Ag+ + NO-3 + Na+ + I- = AgI↓ + Na+ + NO-3.
За таблицею розчинності кислот, основ, амфотерних гідроксидів і солей у воді (див. другий форзац) визначаємо, що арґентум(І) йодид випав в осад, оскільки ця сіль є нерозчинною у воді. Тому в рівняннях реакцій біля AgІ ставимо стрілку донизу.
Суть цієї реакції полягає у взаємодії йонів Ag+ і I- з утворенням недисоційованої сполуки AgI, що випала в осад.
Скорочено записуємо так:
![]()
Отже, другий випадок, коли реакції обміну в розчинах електролітів відбуваються, — це випадання осаду.
Дослід 3. Взаємодія калій сульфіту з хлоридною кислотою.
У пробірку з розчином калій сульфіту доллємо хлоридну кислоту. Під час реакції відбувається виділення бульбашок газу (рис. 38).
Напишемо рівняння реакції:
K2SO3 + 2HCl = 2KCl + H2SO3.

Рис. 38. Взаємодія калій сульфіту з хлоридною кислотою
Вам уже відомо, що сульфітна кислота є нестійкою, вона розпадається на сульфур(IV) оксид і воду. Тому рівняння реакції можна подати інакше:
K2SO3 + 2HCl = 2KCl + SO2↑ + H2O.
Йонні рівняння записуємо так:
2К++ SO2-3 + 2H+ + 2Cl- = 2К++ 2Cl- + SO2↑ + H2O;
2H+ + SO2-3 = SO2↑ + H2O.
Отже, реакція обміну відбулася між катіонами Гідрогену й сульфіт-аніонами, унаслідок чого утворилися молекули сульфур(IV) оксиду та води.
Виділення газу свідчить про те, що реакція йонного обміну в розчинах електролітів відбулася. Це третій випадок, коли реакції в розчинах електролітів відбуваються.
Підсумовуючи результати демонстраційних дослідів, робимо висновок, що основною умовою їх перебігу є наявність у розчинах катіонів та аніонів, які реагують між собою. Отже, реакції відбуваються у випадках, коли:
1) утворюється речовина, що є слабким електролітом;
2) випадає осад (продукт реакції нерозчинний або малорозчинний);
3) виділяється газ.
• Складіть самостійно три рівняння реакцій йонного обміну між розчинами електролітів, коли задовольняються окремо всі три умови їх перебігу. Користуйтеся для складання йонних рівнянь таблицею розчинності кислот, основ, амфотерних гідроксидів і солей
ПІДСУМОВУЄМО ВИВЧЕНЕ
• Реакції обміну, що відбуваються в розчинах електролітів, називають йонними, а їх рівняння — йонними рівняннями.
• Основною умовою перебігу реакцій йонного обміну є наявність у розчинах йонів, здатних взаємодіяти між собою.
• Реакції йонного обміну відбуваються, якщо: 1) утворюються малодисоційовані речовини (вода); 2) випадає осад; 3) виділяється газ.
• Рівняння, які містять не тільки йони, а й формули сполук, називають йонно-молекулярними.
• Реакції йонного обміну виконують біологічно важливі функції в організмах людини, рослин і тварин.
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ: опрацювати п. 12-13 підручника, відео
- 1. Визначте, між якими попарно взятими речовинами реакції йонного обміну відбудуться: а) ZnCl2 i AgNO3; б) KCl i HNO3; в) FeCl3 i NaOH; г) Al(NO3)3 i NaBr; ґ) K2SO4 i Ba(OH)2; д) Na2CO3 i HCl.
- 2. Напишіть рівняння реакцій між електролітами в розчині в молекулярній, повній і скороченій йонних формах, де це можливо: а) FeCl2 + LiOH →; б) Ca(NO3)2 + Na2CO3 →; в) BaCl2 + K2CO3 →; г) Na2SO3 + HCl →; ґ) HNO3 + KOH →.
Електроліти, неелектроліти
Речовини, розчини або розплави яких проводять електричний струм, називаються електролітами. Речовини, розчини або розплави які не проводять електричного струму, називаються неелектролітами.
Електроліти під час розчинення у воді розпадаються (дисоціюють) на позитивно й негативно заряджені йони. Розпад на йони здійснюється під дією диполів води. Іони в розчині перебувають у гідратованому стані, тобто вони оточені диполями води. Під дією електричного струму позитивно заряджені йони (катіони) рухаються до катода, негативно заряджені (аніони) — до анода. Завдяки руху йонів розчини електролітів проводять електричний струм. У розчинах на іони розпадаються речовини з іонним і ковалентним полярним зв'язком.
Ступінь дисоціації
Ступінь дисоціації — відношення числа молекул, що розпалися на йони, до загального числа розчинених молекул. Ступінь дисоціації виражається в частках одиниці або у відсотках. Якщо ступінь дисоціації менший 3 %, то електроліт називається слабким, якщо більший 30 % — сильним. Електроліти, ступінь дисоціації яких лежить у межах від 3 до 30 %, називаються електролітами середньої сили.
Електролітична дисоціація кислот, лугів, солей
- Кислоти дисоціюють на катіони Гідрогену й аніони кислотного залишку.
- Луги дисоціюють на катіони металу (або йони амонію) та аніони гідроксидної групи.
- Солі дисоціюють на катіони металу (або йони амонію) та аніони кислотного залишку.
- На йони не розпадаються осади, гази, а також вода — сполука, яка мало дисоціює.
Масова частка (ω) розчиненої речовини показує, яку масу речовини розчинено у 100 г розчину.
Наприклад, зазначено, що масова частка розчиненої речовини дорівнює 10 %. Це означає, що у 100 г розчину розчинено 10 г якоїсь речовини. Води в цьому розчині 100г - 10г = 90г.
Зверніть увагу, що по суті неважливо, яку речовину розчинено, тому що для розрахунків цієї концентрації використовується маса, а 10 г солі або лугу — це просто 10 г.
Іноді говорять (і пишуть у завданнях) просто «масова частка розчину», опускаючи слова «розчиненої речовини». Можливе й таке формулювання: «20 %-й розчин» — це означає, що масова частка розчиненої речовини дорівнює 20 %.
Масу розчину можна розрахувати, склавши масу розчиненої речовини (або речовин) з масою розчинника:
mр-ну = mр.р-ни + mр-ка,
де mр-ну — маса розчину, mр.р-ни — маса розчиненої речовини, mр-ка — маса розчинника.
Звідси легко знайти масу розчинника (води):
mр.р-ка = mр-ну - mр. р-ни
Для розв'язання задач нам знадобиться формула для розрахунку масової частки:

Із формули випливає, що масова частка розчиненої речовини дорівнює відношенню маси розчиненої речовини до загальної маси розчину. Очевидно, що масова частка буде виражена в частках одиниці (ми ж меншу величину ділимо на більшу).
Масову частку можна виражати у відсотках. У цьому випадку у формулу слід додати множення на 100 %:


РОЗРАХУНКОВІ ЗАДАЧІ
Тепер можна приступати до більш складних задач.
Приклад 1. Обчисліть масу натpій гідроксиду, необхідного для взаємодії з 200 г pозчину гідpоген хлориду, якщо масова частка кислоти 10 %.


Тепер спробуйте розв'язати задачі самостійно.
Задача 1. Кальцій карбонат реагує з розчином нітратної кислоти. Визначте масу солі, що прореагує з 350 г розчину кислоти з масовою часткою HNO3 5 %.
Відповідь: 13,8 г.
Задача 2. Який об'єм водню (н. у.) виділиться внаслідок взаємодії цинку з розчином гідроген хлориду масою 180 г з масовою часткою кислоти 12 %.
Відповідь: 6,6 л.
Приклад 2. Розчин гідроген хлориду масою 40 г нейтралізували кальцій гідроксидом. Визначте масову частку (у %) гідроген хлориду в розчині, якщо було витрачено 37 г Ca(OH)2.


Д.З.Опрацювати матеріали підручника і сайту.
Розв'язуємо самостійно.
Задача 3. Розчин сульфатної кислоти масою 160 г повністю прореагував з цинком масою 13 г. Визначте масову частку кислоти в розчині. (Відповідь: 12,25 %)
Задача 4. Під час проведення хімічного експерименту треба було розчинити осад алюміній гідроксиду масою 39 г. Яка маса розчину нітратної кислоти з масовою часткою HNO3 5 % необхідна для цього? (Відповідь: 1890 г)
Певні уявлення про кількісні характеристики розчинів ви дістали вивчаючи розчинність речовин та її залежність від різних чинників (пригадайте, яких саме). Відносні кількості компонентів розчину можуть змінюватися в досить широких межах (поміркуйте й висловіть припущення, який чинник визначає ці межі). Під час роботи з розчинами важливо знати їхній кількісний склад, зокрема масову частку розчиненої речовини. Цю важливу кількісну характеристику завжди зазначають на етикетках хімічних реактивів, харчових продуктів, лікарських засобів у формі розчинів. Наприклад, масова частка брильянтового зеленого в його спиртовому розчині становить 1 %; масова частка амоніаку в його водному розчині - 10 %; масова частка оцтової кислоти у столовому оцті – 6 %, а масова частка гідроген пероксиду в його водному розчині - 3 % (виразіть ці масові частки у частках від одиниці).
Якщо препарат призначений для лікування дітей, то масова частка розчиненої речовини в ньому зазвичай у кілька разів менша, ніж у ліках для дорослих.
Запам'ятайте! Важливо уважно читати етикетки на споживчих товарах, аби не сплутати, наприклад, столовий оцет, масова частка оцтової кислоти в якому не перевищує 9 %, з оцтовою есенцією. Масова частка оцтової кислоти в ній становить 70 %. Помилкове вживання есенції замість столового оцту може спричинити важкі хімічні опіки органів травлення.
Поняття масової частки вже відоме вам з курсу хімії 8-го класу.
Завдання
Обчисліть масову частку Оксигену в кальцій карбонаті. Для цього спочатку обчисліть відносну формульну масу цієї сполуки. Далі визначте відносну масу атомів Оксигену в ній. Частка від ділення відносної маси атомів Оксигену на відносну формульну масу сполуки і буде шуканою величиною. Величини, які називають частками компонентів (складових частин) системи, або просто частками, використовують для кількісної характеристики складу речовини, суміші або розчину. Обчислюють мольні (x) об ємні (ф) та масові (w) частки компонентів. З малюнка 7.1 легко зрозуміти, що сума часток компонентів становить 1, або 100 %.
Завдання
Виберіть правильне твердження. Масова частка води в розчині з масовою часткою сульфатної кислоти 0,3 становить: А 30 %; Б 40 %; В 70 %; Г 7 %; Д 3 %.
• Масова частка розчиненої речовини — це відношення її маси до загальної маси розчину.
Масову частку розчиненої речовини в бінарному розчині обчислюють за формулою
де w(Х) - масова частка розчиненої речовини X;
m(Х) - маса розчиненої речовини X, г;
m(S) - маса розчинника S, r;
m(розчину) = m(Х) + m(S), г.
Розгляньмо приклад розрахунків з використанням масової частки розчиненої речовини. Визначимо масову частку натрій нітрату розчину, для виготовлення якого було взято натрій нітрат масою 20 г воду об'ємом 180 мл.
Запишемо скорочено умову задачі й виконаємо необхідні розрахунки. Які формули для цього знадобляться, легко зрозуміти зі співвідношень, наведених на схемах (мал. 7.2).
Стисло про головне
Відносні кількості компонентів розчину можуть змінюватися в досить широких межах, які залежать від розчинності речовини. Масова частка розчиненої речовини - важлива кількісна характеристика розчинів.
Величини, які називають частками компонентів (складових частин) системи або просто частками, використовують для кількісної характеристики складу речовини, суміші або розчину. Обчислюють мольні (x), об'ємні (ф) та масові (w) частки компонентів. Сума часток компонентівтстановить 100 %, або 1.
• Масова частка розчиненої речовини - це відношення її маси до загальної маси розчину. У бінарному розчині її обчислюють за формулою
де w(Х) - масова частка розчиненої речовини X;
m(Х) - маса розчиненої речовини X, г;
m(S) - маса розчинника S, r;
m(розчину) = m(Х) + m(S), г.
Чимало речовин, солей зокрема, кристалізуються з розчинів у формі гідратів. Тому, якщо треба виготовити розчин з використанням кристалогідрату, слід спочатку обчислити масу та кількість (моль) безводної солі, яка відповідає необхідній масі кристалогідрату. Оскільки кількості (моль) безводної солі й кристалогідрату рівні, можна обчислити масу кристалогідрату. Масу води обчислюють за різницею маси розчину й кристалогідрату.
Розрахунки, пов'язані з виготовленням розчинів, ґрунтуються на розумінні понять «розчин», «розчинник», «розчинювана речовина», «масова частка компонента розчину», «кристалогідрат», знанні співвідношень, наведених на малюнках 7.2 і 7.3, та вмінні ними оперувати.
Уміння обчислювати маси компонентів розчину необхідні під час роботи в хімічних лабораторіях і на багатьох виробництвах. Знадобляться зони й у побуті.
Д.З. Вивчити матеріал підручника, відеоматеріали.
Розчинність речовин. Важливість розчинів у живій і неживій природі важко переоцінити. За їхньою участю відбувається обмін речовин в організмах людини, тварин і рослин. Їх широко застосовують у різних галузях промисловості, техніці, у хімічних лабораторіях, сільському господарстві, побуті.
Вивчаючи хімію в попередніх класах, ви проводили лабораторні досліди та практичні роботи з використанням розчинів неорганічних речовин. Тому важливо знати, що таке розчинність і як вона залежить від різних чинників.
Розчинність — це властивість речовин розчинятися у воді або будь-якому іншому розчиннику.
Вода є універсальним розчинником завдяки будові та здатності утворювати водневі зв'язки не тільки між своїми молекулами, а й з молекулами інших речовин.
У воді розчиняються речовини, що перебувають у різних агрегатних станах: твердому (рис. 20), рідкому й газоподібному.

Рис. 20. Розчинення кристалів калій перманганату
За розчинністю у воді речовини поділяють на розчинні, малорозчинні й нерозчинні (рис. 21). Такий поділ ґрунтується на тому, яка маса речовини розчиняється в певному розчиннику. Наприклад, якщо у воді масою 100 г розчиняється понад 1 г речовини, то вважають, що це розчинна речовина; якщо ж розчиняється менше ніж 1 г речовини — малорозчинна, а якщо менше 0,01 г — нерозчинна.

Рис. 21. Схема класифікації речовин за розчинністю
Отже, сформулюємо уточнене визначення розчинності.
Розчинність — це маса розчиненої речовини, яка за певних умов (температури, тиску) може розчинитися в розчиннику масою 100 г.
До твердих розчинних у воді речовин належать такі солі, як хлориди та нітрати. З інших — усі солі Натрію, Калію та амонію, подані в таблиці розчинності кислот, основ, амфотерних гідроксидів і солей у воді (див. другий форзац). Розчинними у воді є луги.
У воді можуть розчинятися рідини. Деякі з них розчиняються в будь-яких пропорціях. Це, зокрема, сульфатна, нітратна й оцтова кислоти, етанол.
Здатність розчинятися у воді проявляють і газоподібні речовини. Їх розчинність є дуже різною. Вам уже відомо, що такі безоксигенові кислоти, як хлоридна й сульфідна, добувають розчиненням у воді відповідно гідроген хлориду й гідроген сульфіду. Розчинним є амоніак, розчинність якого за нормальних умов досить висока.
До малорозчинних речовин належать кальцій і магній гідроксиди, арґентум(І) сульфат, гази кисень, азот, карбон(ІІ) оксид.
• Наведіть приклади нерозчинних речовин, користуючись таблицею розчинності (див. другий форзац).
Необхідно зазначити, що абсолютно нерозчинних речовин немає. Навіть метали золото й срібло мають здатність у дуже незначних кількостях розчинятися у воді. Катіони Ауруму й Арґентуму, потрапляючи у воду, спричиняють її бактерицидну дію.
Чинники, що впливають на розчинність речовин. Ви вже переконалися, що розчинність речовин є дуже різною. Вона залежить від багатьох чинників, зокрема: природи розчиненої речовини й самого розчинника, температури, тиску (для газів), агрегатного стану розчиненої речовини. Вивчаючи розчинність речовин, дослідники виявили деякі закономірності.
1. Залежність розчинності речовин від їхньої природи та природи розчинника, тобто від хімічної будови й виду зв'язку. Речовини з ковалентним полярним зв'язком добре розчиняються в речовинах, подібних до себе. Наприклад, розчинення амоніаку у воді. Аналогічно розчиняються йонні сполуки, тобто вони добре розчинні в полярних розчинниках. Так, натрій гідроксид і натрій хлорид розчиняються у воді чи іншому полярному розчиннику. Для неполярних сполук характерно розчинятися в неполярних розчинниках. Прикладом може бути розчинення рідкого азоту в рідкому кисні. Отже, сформулюємо правило: подібне розчиняється в подібному.
2. Залежність розчинності речовин від температури. Щоб з'ясувати, як температура впливає на розчинність речовин, проведемо дослід.
Дослід. Покладемо у дві склянки по однаковій грудочці цукру. Наллємо в першу склянку холодну, а в другу гарячу воду масою по 150 г. Що ж ми спостерігаємо? У першій склянці цукор розчиняється повільно, а в другій, з гарячою водою — значно швидше. Отже, з підвищенням температури розчинність зростає. Зокрема, це стосується твердих речовин.
Однак у певній масі води (чи іншого розчинника) може розчинятися не безмежна маса речовини, а певна її порція. Наприклад, експериментально встановлено, що у воді масою 100 г за кімнатної температури (приблизно 20 °С) може розчинитися натрій хлорид масою не більше ніж 36 г. За такої самої температури калій нітрату розчиниться 35 г і приблизно така ж порція калій хлориду. Якщо до згаданих порцій додати ще солі, то за цієї температури вони більше не розчинятимуться.
Розчин, у якому за певної температури й тиску розчинена речовина більше не розчиняється, називають насиченим.
Залежність розчинності твердих речовин від температури відображають криві розчинності (рис. 22). Так, із підвищенням температури розчинність деяких солей зростає (KClO3, KNO3, Pb(NO3)2). Однак є солі, розчинність яких зростає незначно (KCl, NaCl) або зменшується (Cr2(SO4)3).

Рис. 22. Криві розчинності
• Сформулюйте самостійно визначення ненасиченого розчину.
Зрозуміло, що в ненасиченому розчині речовини менше, ніж у насиченому, тож у ньому можна розчинити додаткову порцію речовини. Доливши розчинник у насичений розчин, легко отримаємо ненасичений розчин.
За підвищеної температури в певній масі розчинника можна розчинити більшу порцію речовини. Під час повільного охолодження такого розчину утворюється пересичений розчин, який є дуже нестійким: за незначного струшування або додавання кристалика солі надлишок розчиненої речовини випадає в осад.
3. Залежність розчинності від агрегатного стану розчиненої речовини. Розчини утворюють не тільки тверді речовини, а й рідини та гази. Наприклад, чимало рідин (етанол, оцтова кислота, гліцерол) добре розчиняються у воді й змішуються з нею в будь-яких співвідношеннях.
На розчинність рідин тиск не впливає.
4. Залежність розчинності газів від температури й тиску. Розчинність газів залежить від температури, тиску та хімічної природи самого газу. Розчинення газів у воді супроводжується виділенням тепла, тому з підвищенням температури їхня розчинність зменшується, а зі зниженням — збільшується. Вам уже відомо, що за звичайних умов у воді добре розчиняються такі гази, як гідроген хлорид, амоніак тощо.
На розчинність газів істотно впливає тиск. З підвищенням тиску розчинність газів зростає.
Кількісний склад розчину. Кількісний склад розчину виражають різними способами. Вам уже відомий один з них — це масова частка розчиненої речовини. Є й інші способи, але їх в основній школі не вивчають.
• Пригадайте, що називають масовою часткою речовини в розчині та як її обчислюють.
Залежно від вмісту розчиненої речовини розрізняють концентровані та розведені розчини.
У концентрованому розчині вміст розчиненої речовини є високим і перевищує вміст розчинника. Розведений-розчин характеризується низьким вмістом розчиненої речовини, тобто в ньому міститься більше розчинника. Залежно від того, розчинна чи малорозчинна речовина, концентровані розчини розчиненої речовини можуть бути ненасиченими, а розведені розчини малорозчинної речовини — насиченими.
Д.З. Вивчити п. (4,5) , п. 6-7

- руйнування структури розчинюваної речовини до молекул або йонів;
- взаємодія утворених частинок з частинками розчинника.
Фізико-хімічна суть процесу розчинення. З'ясуємо, у чому полягає суть процесу розчинення. Ви вже спостерігали, як розчиняється у воді кухонна сіль і цукор, тому відразу скажете, що це відбувається внаслідок дифузії. Тобто частинки розчинюваної речовини, зіткнувшись із молекулами води або іншого розчинника, поширюються між ними. Одночасно зменшується маса речовин, які розчиняються. Це свідчить про те, що кристали речовин руйнуються й переходять у розчин. На рисунку 17 зображено, що кристали цукру (сахарози) і кухонної солі (натрій хлориду) руйнуються й молекули та йони хаотично рухаються між молекулами розчинника.
Дослід 2. З'ясуємо, що може пришвидшити розчинення речовин. Для цього візьмемо дві хімічні склянки й наллємо однакові об'єми води. У першу склянку покладемо грудочку цукру, у другу — таку саму грудочку, яку попередньо подрібнемо, щоб утворився цукор-пісок. Спостерігайте, як розчиняється цукор в обох склянках.
Отже, у склянці з подрібненим цукром розчинення відбувається значно швидше. Робимо висновок, що руйнування кристалів цукру залежить від площі поверхні зіткнення розчинника та розчинюваної речовини. Що більша площа поверхні зіткнення, то швидше відбувається дифузія. Збільшити площу поверхні зіткнення можна, якщо розчин перемішати.
Дослідники процесів розчинення, зокрема шведський фізико-хімік С. Арреніус, вважали, що між розчинником і розчиненою речовиною немає жодної взаємодії, тобто розчинення характеризували як фізичний процес. Однак Д. Менделєєв, вивчаючи процес розчинення речовин, запропонував хімічну теорію розчинів. За цією теорією, розчин розглядають не як механічну суміш розчинника й розчиненої речовини, а як хімічну взаємодію між ними.
Під час розчинення речовин спостерігають два процеси: 1) руйнування структури розчинюваної речовини до молекул чи йонів; 2) взаємодію утворених частинок із частинками розчинника (якщо це вода — з молекулами води). Взаємодію частинок речовини з молекулами води називають гідратацією. Продуктами гідратації є гідратовані йони або молекули.
Розглянемо, як відбувається розчинення речовин з різною кристалічною структурою на прикладі найпоширеніших харчових продуктів — цукру (сахарози) і кухонної солі (натрій хлориду).
Цукор (сахароза) є речовиною молекулярної будови. Його молекули містять у своєму складі атоми із зарядами δ+ і δ-, що й зумовлює притягування молекул води протилежними полюсами. Між молекулами цукру та полярними молекулами води утворюються водневі зв'язки. Навколо однієї молекули цукру концентруються декілька молекул води, які сполучаються між собою. Унаслідок такої взаємодії та руху молекул води молекули цукру відокремлюються від кристалів. Отже, відбувається руйнування структури кристала. Другий процес пов'язаний з утворенням гідратованих молекул цукру та рівномірним поширенням і розподілом їх між молекулами розчинника (води).
Розчинення йонних сполук (натрій хлориду) теж характеризується руйнуванням структури кристала й утворенням гідратованих йонів. Дипольні молекули води притягуються до йонів різними полюсами: до позитивно зарядженого йона Натрію — негативним, а до негативно зарядженого йона Хлору — позитивним. Унаслідок взаємного притягання зв'язки між йонами в кристалі руйнуються і йони переходять у розчин. У результаті в розчині утворюються гідратовані катіони Натрію й аніони Хлору (рис. 18).

Рис. 18. Схема процесу розчинення кристалів натрій хлориду у воді
Зважаючи на те, що під час розчинення утворюються гідратовані молекули або йони, розчин містить не тільки розчинник і розчинену речовину, а й продукти їхньої взаємодії. Тому схему складу розчину, подану на рисунку 16 (с. 33), необхідно змінити так, як зображено на рисунку 19.
![]()
Рис. 19. Схема складу розчину
Оскільки під час розчинення речовин відбувається не тільки механічне поширення структурних частинок розчиненої речовини між молекулами розчинника (дифузія), а й взаємодія між ними, що підтверджує процес гідратації з утворенням гідратованих молекул або йонів, то доведено (Д. Менделєєв), що розчинення — це фізико-хімічний процес.
Тому правильним буде доповнене визначення поняття «розчин».
Розчин — це однорідна (гомогенна) система, що складається з двох або більше компонентів і продуктів їхньої взаємодії.
Підтвердженням фізико-хімічної теорії розчинів є теплові явища, що відбуваються під час розчинення.
Д.З. Вивчити п. 4,5
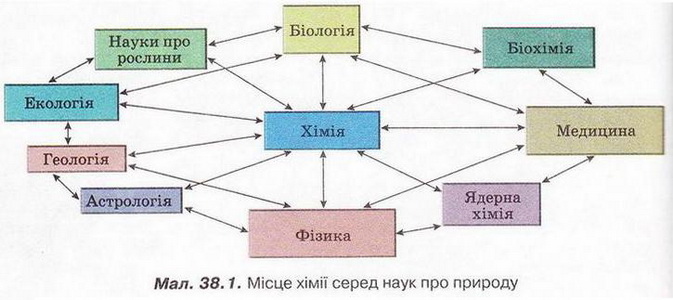
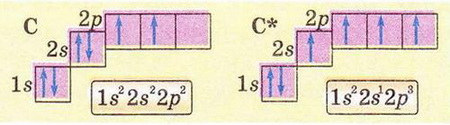

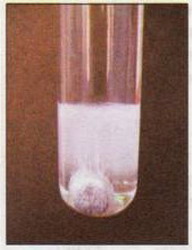
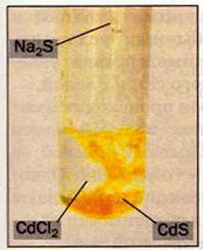
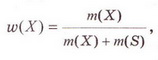
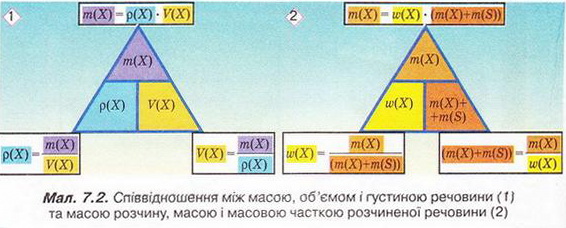

Немає коментарів:
Дописати коментар