Хімія 9 - Б клас
https://meet.google.com/yyy-szea-agg - посилання на онлайн-урок (за розкладом)
10.05. 2022 - 12.05.22
Тема: Природні і синтетичні органічні речовини. Практична робота №5 "Виявлення органічних сполук в харчових продуктах"
https://www.youtube.com/watch?v=NgpovX1i0O4
https://www.youtube.com/watch?v=ehloubpPw-8
Перегляньте відео. Виконайте практичну роботу №5 .
Підручник п. 40, ,завдання 1,2,3
https://meet.google.com/yyy-szea-agg - посилання на онлайн-урок (за розкладом)
03.05. 2022 - 05.05.22
Тема: Узагальнення знань з теми "Оксигеновмісні органічні сполуки"
Завдання 1-6 мають по чотири варіанти відповіді. У кожному завданні лише одна правильна. ( по 0,5 б.)
1.Позначте формулу етилового спирту:
А.С2Н5ОН; Б. НСООН; В.СН3СООН; Г. С17Н35СООН.
2. Загальна формула насичених одноосновних карбонових кислот:
А. Сп(Н2О)m; Б. R1CООR2; В. СпН2п+1СООН; Г. СпН2п +1ОН.
3. Функціональна группа спиртів:
4 . Мила – це речовини, що належать до класу:
А. спиртів; Б. естерів; В. карбонових кислот; Г.солей.
5. Яким реактивом можна скористатися, щоб виявити пропанову кислоту серед інших речовин:
А. лакмус; Б.спиртовий розчин йоду ;
В Сu(ОН)2; Г. бромна вода.
6. Гептанол належить до:
А. карбонових кислот; Б. спиртів; В. альдегідів; Г. жирів.
Завдання 7 – 9 можуть мати дві і більше правильні відповіді.
7. (0,5 б.) Укажіть властивості оцтової кислоти, що спричиняють її застосування у харчовій промисловості:
а) добре розчиняється у воді; б) розчин кислий на смак;
в) змінює забарвлення індикаторів.
8. (0,5 б.) Назвіть галузі застосування етанолу:
а) медицина; б) агропромисловий комплекс; в) електротехніка.
9. (1б.) Позначте речовини, з якими може реагувати оцтова кислота:
А. Mg; Б. Сu; В. Са(ОH)2; Г. С2Н5ОН.
10.(2б.)Закінчити рівняння реакцій:
А. С2Н5ОН + HCl →; В. СН3СООН + Nа → ;
Б. СН3 – СООН + К2СО3 → ; Г. С5Н11ОН + О2 →;
11.(2б.) Здійснити перетворення:
С2Н4 → С2Н5Сl → С2Н5ОН → С2Н4 → С2Н4Сl2.
12. (3б.) Обчисліть об’єм водню, який виділиться внаслідок взаємодії алюмінію з розчином оцтової кислоти масою 700г з масовою часткою кислоти 10 %.
Д.З. виконати роботу, рівняння реакцій, розвязок задачі записуємо повністю.
26.04. 2022 - 28.04.22
Тема: Крохмаль.Целюлоза. Полімерна будова.
Використання вуглеводів, їх біологічна роль. Загальна схема виробництва цукру.
Глюкоза, що утворюється в результаті фотосинтезу, накопичується в плодах, листі та стеблах рослин у формі різних полімерів: крохмалю й целюлози.
Назвіть речовини, що містять велику кількість крохмалю. (Рис, пшениця, картопля та ін.)
Назвіть речовини, що містять целюлозу. (Бавовна, усі рослини) Крохмаль і целюлоза – природні полімери, загальна формула – (C6H10О5) .
Рівняння утворення крохмалю або целюлози можна подати так:
NC6H12O6  (C6H10O5)n + nH2O
(C6H10O5)n + nH2O
Ця реакція називається реакцією поліконденсації, мономер – глюкоза, полімер – целюлоза або крохмаль, побічний продукт – вода.
Ланцюги целюлози побудовані із залишків?-глюкози й мають лінійну будову. Цей біополімер має велику механічну міцність і виконує роль опорного матеріалу рослин, утворюючи стінки рослинних клітин. Використовується у виробництві штучних волокон і паперу. У великій кількості целюлоза міститься в деревині й бавовні.

Молекулярна маса целюлози – від 400 тис. до 2 млн.

Ланки?-глюкози надають ланцюговим молекулам випрямленої форми за рахунок внутрішньо – та міжмолекулярних водневих зв’язків. Тому целюлоза має волокнисту структуру й нерозчинна.
Крохмалем називається суміш двох полісахаридів, побудованих із залишків циклічної?-глюкози.

До його складу входять:
– амілоза (внутрішня частина крохмального зерна) – 10-20 %;
– амілопектин (оболонка крохмального зерна) – 80-90 %. Ланцюг амілози включає 200-1000 залишків?-глюкози (середня молекулярна маса – 160 000) і має нерозгалужену будову.

Ланки?-глюкози “закручують” макромолекулу в спіраль. Це зменшує ймовірність утворення міжланцюгових водневих зв’язків, але збільшує можливість виникнення таких зв’язків з молекулами води. Тому амілоза розчиняється у воді.
Макромолекула амілози являє собою спіраль, кожен виток якої складається із шести ланок?-глюкози.
Під час взаємодії амілози з йодом у водному розчині молекули йоду входять у внутрішній канал спіралі, утворюючи так звану сполуку включення. ця сполука має характерний синій колір. Ця реакція використовується для виявлення як крохмалю, так і йоду (йод-крохмальна проба).
https://www.youtube.com/watch?v=AiE7i0fZV7w - перегляньте відео
https://www.youtube.com/watch?v=EImEFFixxvw - перегляньте відео про виробництво цукрк в Україні.
Д.З. Опрацювати відеоматеріали, матеріал підручника п.37,38
https://meet.google.com/yyy-szea-agg - посилання на онлайн-урок (за розкладом)
19.04. 2022 - 21.04.22
Тема: Поняття про вищі карбонові кислоти. Жири. Склад, утворення. Жири в природі.
Вуглеводи. Глюкоза і сахароза. Будова, властивості, застосування.
Жири — це складні органічні речовини, до складу яких входять залишки вищих одноосновних карбонових кислот і гліцеролу.
Зі спиртом гліцеролом ми вже ознайомилися, що таке карбонові кислоти теж знаємо. Що ж таке вищі карбонові кислоти?
Вищими кислотами називають карбонові кислоти, до складу яких входить більше 10 атомів Карбону.
Основні вищі кислоти, що входять до складу жирів
1) Насичені:
- пальмітинова кислота C15H31COOH;
- стеаринова кислота C17H35COOH.
2) Ненасичені з одним подвійним зв'язком:
- олеїнова кислота C17H33COOH.
3) Ненасичені з двома подвійними зв'язками:
- лінолева кислота C17H31COOH.
Називають жири виходячи з назв карбонових кислот, які їх утворюють: тристеарат (входять три залишки молекули стеаринової кислоти), триолеат (входять три залишки молекули олеїнової кислоти). До складу жиру часто входять залишки молекул різних кислот. Загальна назва — тригліцериди.
Формули жирів великі й складні, ви будете вивчати у старших класах, як їх складати. Зараз просто наведемо формулу жиру тристеарату:

Загальна структурна формула (рис. 76) й об'ємна модель жиру (рис. 77):

Рис. 76. Загальна структурна формула жиру

Рис. 77. Об'ємна модель жиру
ФІЗИЧНІ ВЛАСТИВОСТІ ЖИРІВ
За кімнатної температури жири бувають рідкими й твердими. Агрегатний стан жирів обумовлений жирними кислотами, що входять до їхнього складу. Тверді жири (масла) утворені насиченими кислотами, рідкі жири (олії) — ненасиченими. Температура плавлення жиру тим вище, чим більше в ньому насичених кислот і чим довший кислотний радикал.
Тваринні жири частіше тверді (яловичий, баранячий), але трапляються й рідкі (риб'ячий жир). У той же час рослинні жири частіше рідкі речовини (лляна, соняшникова олія), але є й тверді (кокосове масло, масло какао) (рис. 78). Природні жири являють собою не індивідуальну речовину, а суміш тригліцеридів.

Рис. 78. Тваринні та рослинні жири
ЗАСТОСУВАННЯ ЖИРІВ

Рис. 79. Сфери застосування жирів
БІОЛОГІЧНА РОЛЬ ЖИРІВ
Жири дуже поширені в природі. Поряд із вуглеводами й білками вони входять до складу всіх рослинних і тваринних організмів і становлять одну з основних частин нашої їжі.
В організмі жири, які входять до складу їжі, під впливом ферментів підшлункового і кишкового соку перетворюються на гліцерол і карбонові кислоти — всмоктуються в кишечнику й знову утворюють жир, необхідний для організму.

Будучи гарним теплоізолятором, жири у складі підшкірної жирової клітковини підтримують нормальну температуру тіла шляхом зменшення втрати тепла організмом і є амортизатором у разі механічних впливів. У разі виснаження людське тіло дуже швидко втрачає тепло. Це особливо небезпечно для дітей.
Жири оточують внутрішні органи: серце, печінку, нирки і т. д. і є ніби «подушками» для їх м'якої фіксації. У разі виснаження деякі органи змінюють своє положення, що призводить до різних патологічних ситуацій.
Жири необхідні для вироблення багатьох гормонів та інших біологічно активних сполук, які регулюють усі процеси життєдіяльності.
Жири — гарні розчинники. Багато речовин, які не розчиняються у воді, розчиняються в жирах. Так, жиророзчинні вітаміни А, D, E і каротин потрапляють в організм разом із ними.
Під час окиснення жирів в організмах утворюються вода (з 1 г жиру утворюються 1,1 г води). Це допомагає, наприклад, верблюдам обходитися тривалий час без води.
ДОМАШНІЙ ЕКСПЕРИМЕНТ
Під час виконання дослідів дотримуйтеся правил безпеки! Просимо допомоги батьків!
Досліджуємо якість вершкового масла
До складу маргарину, згідно з технологічними умовами, на відміну від вершкового масла, входить крохмаль (0,2 %). Нагрійте маленький шматочок вершкового масла до плавлення. Декілька крапель водного шару, що утворюється знизу під шаром жиру, відберіть піпеткою, помістіть у металеву столову ложку, долийте стільки ж кип'яченої води й нагрійте до кипіння. Після охолодження додайте 1-2 краплини спиртового розчину йоду. У справжньому вершковому маслі посиніння не відбуватиметься. Якщо ви помітите посиніння, значить, у вершкове масло було додано маргарин.
Підсумок:

https://www.youtube.com/watch?v=UjTESozUf44 - перегляньте відео про вуглеводи
Д.З. опрацювати відеоматеріали, підручник п.36-37
https://meet.google.com/yyy-szea-agg - посилання на онлайн-урок (за розкладом)
12.04. 2022 - 14.04.22
05.04.2022 - 07.04.2022
Тема: Поняття про вищі карбонові кислоти.
Практична робота №4:"Властивості етанової (оцтової) кислоти.
Вищими карбоновими кислотами називають карбонові кислоти, у молекулах яких міститься від 12 до 22 атомів Карбону. Як і вуглеводи, вищі карбонові кислоти можуть бути насиченими (мають тільки одинарні заявки) та ненасиченими (мають один або декілька подвійних зв’язків).
З насичених вищих карбонових кислот найчастіше трапляються стеаринова й пальмітинова кислоти.
Формула стеаринової кислоти: С17Н35СООН.
Формула пальмітинової кислоти: С15Н31СООН.
Стеаринова та пальмітинова кислоти – тверді білі воскоподібні речовини без запаху, жирні на дотик, нерозчинні у воді, але добре розчинні в органічних розчинниках, легкоплавкі. Їх використовують для виготовлення свічок, мастил, косметичних засобів і різних сортів мила.
Ненасичених вищих карбонових кислот існує набагато більше, ніж насичених. Серед них найпоширенішими є: олеїнова С17Н33СООН, лінолева С17Н31СООН, ліноленова С17Н29СООН.
Ненасичені вищі карбонові кислоти – безбарвні або світло-жовті маслянисті рідини без запаху, нерозчинні у воді, але добре розчинні в багатьох органічних розчинниках. Їх застосування в техніці принципово не відрізняється від насичених кислот, але вони набагато цінніші для людини як поживні речовини у складі жирів.
Мило і його мийна дія.
Мило – це солі вищих карбонових кислот з Натрієм або Калієм. До складу мила входять натрієві та калієві солі вищих карбонових кислот: стеаринової та пальмітинової. Натрієві солі вищих карбонових кислот є основною складовою частиною твердого мила, калієві солі – рідкого мила.
Мило має такі властивості як твердість, розчинність у воді, здатність до піноутворення, мийна здатність. Властивості залежать від складу карбонових кислот. Пальмітинова кислота забезпечує твердість і високе піноутворення, олеїнова – розчинність у холодній воді і мийну здатність, стеаринова кислота – посилює дію мила у гарячій воді. Високоякісні сорти мила виготовляють з додаванням лауринової кислоти С11Н23СООН, що міститься в кокосовому маслі.
У промисловості мило добувають лужним гідролізом жирів. Цей процес ще називають омиленням жирів. Для омилення жирів замість лугу можна використовувати соду Na2CO3. Мило, добуте внаслідок цієї реакції, називається господарське мило. Туалетне мило відрізняється від господарського наявністю добавок: барвників, запашних речовин, антисептиків тощо (демонстрація омилення жиру
08.02.2022 - 10.02.2022
Тема: Етилен і ацетилен. Молекулярні та структурні формули,фізичні властивості.
Алкени (або етиленові вуглеводні) – вуглеводні із загальною формулою СnН2n, в молекулах яких між атомами Карбону є один подвійний зв’язок.
Щоб дати назву алкенам, у назві відповідного алкану суфікс -ан замінюють на –ен. Алкіни (або ацетиленові вуглеводні) – вуглеводні із загальною формулою СnН2n-2, в молекулах яких між атомами Карбону є один потрійний зв’язок.
Щоб дати назву алкінам, у назві відповідного алкану суфікс -ан замінюють на –ин або –ін. Будова молекул етилену і ацетилену Ознака Етилен (алкен) Ацетилен (алкін)
Особливості будови Має 1 подвійний зв’язок С=С Має 1 потрійний зв’язок -С≡ СМолекулярна формула С2Н4 С2Н2 Електронна формула Н:С:::С:Н Структурна формула Н Н С=С Н Н Н – С ≡ С - Н Порівняння будови алканів, алкенів, алкінів Алкани (етан) Алкени (етен) Алкіни (етин)
1. Структурні формули Н Н | | Н – С - С – Н | | Н Н Н Н С=С Н Н Н – С ≡ С - Н
2.Тип гібридизації в атомах С SP3 SP2 SP
3. Кількість гібридних хмар 4 3 2
4.Кут між осями гібридних хмар 109,5º (109,28) 120 º 180 º
5.Зв’зки між атомами С Лише σ зв’язки 1 σ і 1 π 1 σ і 2 π 6.Відстань між атомами С 0,154 нм 0,134 нм 0,120 нм
Фізичні властивості етилену і ацетилену 1. Гази – прозорі. Безбарвні 2. Майже без запаху (С2Н4 слабкий солодкуватий запах) 3. Малорозчинні у воді 4. Легші за повітря : М(С2Н4) = 28 г/моль М (С2Н2) = 26 г/моль М(повітря) = 29 г/моль
https://www.youtube.com/watch?v=Gkr6I6F9u20
Домашнє завдання: переглянути відео і матеріали підручника п.28. Скласти конспект
01.02.2022 - 03.02.2022
Тема: Метан. Молекулярна, електронна і структурна формула. Поширення в природі. Гомологи метану. Фізичні властивості гомологів метану.
Метан (рудниковий, або болотний, газ) має молекулярну формулу CH4. Його електронна та структурна формули, а також модель молекули у формі тетраедра мають такий вигляд:

Метан — безбарвний газ, без запаху, погано розчинний у воді, легший за повітря. Назву «болотний газ» метан одержав через те, що він утворюється під час гниття рослинних залишків на дні болот без доступу повітря. Метан є основою атмосфери Сатурна, Юпітера та його супутника Титана.
Метан є першим, найпростішим представником гомологічного (від грец. однаковий) ряду алканів, або насичених вуглеводнів. Починаючи з метану CH4, можна побудувати ряд сполук, у якому кожен наступний член відрізнятиметься від попереднього на одну групу атомів —CH2—. Останню називають метиленовою групою, або гомологічною різницею.
Гомологи — це сполуки, які мають однотипну будову та близькі хімічні властивості, але відрізняються кількістю груп —CH2—.
У ряду алканів, тобто насичених органічних сполук, атоми Карбону сполучені між собою тільки простими (одинарними) хімічними зв’язками, інші їхні валентності насичені атомами Гідрогену. Вони утворюють гомологічний ряд із загальною формулою CnH2n + 2, тобто ряд насичених вуглеводнів з відкритим ланцюгом, де n — натуральне число 1, 2, 3 і т. д., що відображає кількість атомів Карбону в молекулі алкану.
Склад і назви перших 10 членів гомологічного ряду алканів, або ряду метану, подано в таблиці 9.
Назви перших чотирьох членів гомологічного ряду алканів — метан, етан, пропан, бутан — є історичними. Назви інших алканів з нерозгалуженим ланцюгом складають із грецької або латинської назви числівника, яка відповідає кількості атомів Карбону в ланцюзі, з додаванням суфікса -ан. Так, грецька назва числівника 6 — гекса, тому вуглеводень C6H14 має назву гексан.
Таблиця 9
Назви, молекулярні та структурні формули алканів

https://www.youtube.com/watch?v=4YugYX_5Qr8
https://www.youtube.com/watch?v=3cvnbczhFgg
Домашнє завдання: переглянути відео і матеріал підручника. Скласти конспект.
23.12.2021
Тема: Складання найпростіших окисно-відновних реакцій. Підбір коефіцієнтів.
Скласти рівняння окисно-відновної реакції, яка описана схемою:
CuSO4 + Р + Н2O → Cu + Н3РО4 + H2SO4
1. Спочатку визначаємо ступінь окиснення кожного елемента в речовинах-реагентах та речовинах-продуктах:
![]()
2. З'ясовуємо, в атомів яких елементів відбувається зміна ступеня окиснення. Як бачимо, атом Фосфору змінює ступінь окиснення від 0 до +5, він — відновник, а сам при цьому окиснився. Ступінь окиснення атома Купруму змінився від +2 до 0, а сам він виступив окисником і відновився.
3. Записуємо обидві схеми:
![]()
Зверніть увагу, що кількість електронів, які віддає відновник (5) і які приєднує окисник (2), у схемах є різною.
4. Для того щоб зрівняти кількості електронів, які віддав відновник (5e-) і приєднав окисник (2е-), необхідно дібрати множник для кожного із зазначених процесів. Для цього шукаємо найменше спільне кратне (2 · 5 = 10):

Операцію з пошуку найменшого спільного кратного можна не записувати, а виконувати усно.
5. Відділяємо схеми вертикальною лінією і записуємо множники 2 і 5 (2 — до процесу окиснення, а 5 — до процесу відновлення):

Множники 2 і 5 є коефіцієнтами, які потрібно поставити в схему реакції, щоб перетворити її на рівняння. Коефіцієнт 2 ставимо перед формулами фосфору й ортофосфатної кислоти, а 5 — перед формулами міді й купрум(ІІ) сульфату (зауважте, що передусім коефіцієнти ставлять перед формулами речовин, у яких ступінь окиснення елемента дорівнює 0). Одержуємо:
5CuSO4 + 2Р + Н2О → 5Сu + 2Н3РО4 + H2SO4
6. Продовжуємо добирати коефіцієнти. Зважаючи на те, що в лівій частині схеми є 5 атомів Сульфуру, ставимо коефіцієнт 5 перед формулою сульфатної кислоти:
5CuSO4 + 2Р + Н2О → 5Сu + 2Н3РО4 + 5H2SO4
Обчислимо кількість атомів Гідрогену: у правій частині схеми їх є 16 (6 — у двох молекулах Н3РО4 і 10 — у п'яти молекулах H2SO4). Отже, перед формулою води поставимо коефіцієнт 8:
5CuSO4 + 2Р + 8Н2О → 5Cu + 2Н3РО4 + 5H2SO4
Нарешті, перерахувавши атоми Оксигену в лівій і правій частинах рівняння, переконуємось, що їх є по 28.
5CuSO4 + 2Р + 8Н2О = 5Cu + 2Н3РО4 + 5H2SO4
У кожному рівнянні окисно-відновної реакції бажано вказати речовини чи йони, що є окисниками і відновниками:
![]()
2. Розгляньмо окисно-відновну реакцію, схема якої:
S + Сl2 + H2O → H2SO4 + HCl
Розставивши ступені окиснення всіх елементів, одержимо:
![]()
Запишемо схеми процесів окиснення та відновлення, поставимо множники 2 і 6, які можна скоротити до 1 і 3:

Кількість атомів Сульфуру в правій і лівій частинах однакова (дорівнює 1). Перед Сl2 ставимо коефіцієнт 3:
S + 3Cl2 + H2O → H2SO4 + HCl
Кількість атомів Хлору в лівій частині — 6. Щоб у правій частині також отримати 6 атомів, ставимо перед НСl коефіцієнт 6:
S + 3Сl2 + Н2O → H2SO4 + 6НСl
Обчислимо кількість атомів Гідрогену в правій частині рівняння: їх 8. Отже, перед формулою води потрібно поставити коефіцієнт 4:
S + 3Сl2 + 4Н2О → H2SO4 + 6НСl
Перевіряємо кількість атомів Оксигену: їх по 4 у правій і лівій частинах. Отже:
S + 3Сl2 + 4Н2О = H2SO4 + 6НСl
Указуємо окисник і відновник:
![]()
Приклад 3. Розгляньмо добір коефіцієнтів для окисно-відновної реакції, схема якої:
FeO + HNO3 (розб.) → Fe(NO3)3 + NO + Н2О
Указавши ступені окиснення елементів, одержимо:
![]()
Записуємо схеми процесів окиснення і відновлення, ставимо множники, щоб збалансувати електрони:

Перед формулами FeO і Fe(NO3)3 ставимо коефіцієнт 3. Одержуємо:
3FeO + HNO3 (розб.) → 3Fe(NO3)3 + NO + Н2О
Коефіцієнт 1 стосується лише NO, тому що частина атомів Нітрогену в йоні NO-3 не відновилась, а увійшла до складу солі — ферум(ІІІ) нітрату. Обчислюємо загальну кількість атомів Нітрогену в правій частині рівняння: їх є 10 (9 + 1). Отже, перед формулою нітратної кислоти ставимо коефіцієнт 10:
3FeO + 10HNO3 (розб.) → 3Fe(NO3)3 + NO + Н2О
Щоб зрівняти кількість атомів Гідрогену, необхідно перед формулою води поставити коефіцієнт 5:
3FeO + 10HNO3 (розб.) → 3Fe(NO3)3 + NO + 5Н2О
Підрахувавши кількість атомів Оксигену в лівій і правій частинах рівняння, переконуємося у правильності його написання (по 33 атоми Оксигену):
3FeO + 10HNO3 (розб.) = 3Fe(NO3)3 + NO + 5Н2O
У цьому рівнянні окисно-відновної реакції відновник — ферум(ІІ) оксид FeO, тому що до його складу входить йон Fe2+, який віддав електрони. Окисником виступає нітратна кислота HNO3. У її складі є аніон NO-3, а в аніоні — атом Нітрогену з найвищим ступенем окиснення +5, який приєднав 3 електрони. Отже, підсумовуючи все, запишемо:
![]()

Підсумки
- 1. Рівняння окисно-відновних реакцій складають, використовуючи метод електронного балансу.
- 2. Для добору коефіцієнтів керуються правилом: кількість електронів, які віддає відновник (атоми, молекули чи йони), має дорівнювати кількості електронів, які приєднує окисник.
- 3. Правильно складене рівняння окисно-відновної реакції забезпечує точне написання схем процесів окиснення і відновлення та встановлення множників, щоб збалансувати електрони.
Контрольні запитання
- 1. Опишіть основні етапи складання електронного балансу для окисно-відновної реакції.
- 2. Чи правильним є твердження, що два атоми Нітрогену, що утворюють молекулу азоту, приєднуючи 6е-, окиснюються? Запишіть схему цього процесу та назвіть його.
- 3. Як називають процес, описаний схемою:
![]()
- 4. Чи правильним є твердження, що Оксиген в описаній схемі відновлюється:
![]()
- 5. Яку кількість електронів втрачає (чи приєднує) Нітроген у процесі окиснення (чи відновлення), що відповідає схемам:
![]()
Вправи та задачі
1. Складіть рівняння окисно-відновних реакцій за наведеними схемами, використавши метод електронного балансу:
- a) N2 + Н2 → NH3;
- б) KNO3 + С → KNO2 + CO2;
- в) FeCl2 + Сl2 → FeCl3;
- г) SO2 + О2 → SO3.
Укажіть речовини — окисники та відновники, процеси окиснення і відновлення.
2. Завершіть схеми наведених процесів:

3. За допомогою методу електронного балансу здійсніть добір коефіцієнтів для окисно-відновних реакцій, перебіг яких описано схемами:
- а) SO2 + HNO3 + Н2О → H2SO4 + NO↑;
- б) ΝΗ3 + О2 → N2 + Н2O;
- в) S + HNO3 → SO2↑ + ΝΟ2↑ + Н2O;
- r) H2S + O2 → SO2 + H2O.
Домашнє завдання: п. 19-20
04.11.2021
Тема: Реакція обміну між розчинами електролітів, умови протікання реакцій.
Реакції обміну між розчинами електролітів. Йонні рівняння
Велика кількість хімічних реакцій проходить у розчинах. У таких реакціях обміну найчастіше беруть участь солі, кислоти, основи. Але чимало солей, кислот й основ у розчинах дисоціюють на йони, отже реакції в розчинах відбуваються не між молекулами, а між йонами. Такі реакції називають йонними.
Якщо хімічні реакції у водних розчинах електролітів відбуваються за участю йонів, то і хімічні рівняння, які відображають йонні реакції, слід записувати не лише в молекулярній, а й у йонній формі. Такі рівняння називають йонними рівняннями.
Для складання йонних рівнянь спочатку записують молекулярне рівняння реакції, наприклад:
NaOH + HCl = NaCl + H2O.
У другому рядку записуємо йонне рівняння. Для цього формули сильних електролітів потрібно записати в йонній формі. Для визначення сили електролітів можна користуватися таблицею розчинності, пам’ятаючи, що до сильних електролітів належать розчинні сполуки. Їхні формули записуємо в йонній формі. Вода є неелектролітом, тому її записуємо в молекулярній формі:
Na+ + OH- + H+ + Cl- = Na+ + Cl- + H2O.
Таке рівняння називається повним йонним рівнянням.
У лівій і правій частинах йонного рівняння є однакові йони Na+ (натрій-плюс) і Cl– (хлор-мінус). Ці йони можна видалити з лівої та правої частин йонного рівняння, оскільки вони не беруть участі в реакції. Скорочуємо в лівій і правій частинах рівняння катіони Натрію та аніони Хлору — й одержуємо скорочене йонне рівняння. У ньому записані тільки ті частинки, які реально взаємодіють у розчині:
OH- + H+ = H2O.
Реакції обміну в розчинах електролітів відбуватимуться до кінця, якщо один із продуктів реакції є неелектролітом. У цьому разі відбувається сполучення йонів, що утворюють неелектроліт, і вони виходять із сфери реакції. Це можливо, якщо в результаті реакції:
1) утворюється нерозчинна речовина (випадає осад),
2) виділяється газ,
3) утворюється вода або інший слабкий електроліт (Н2S, Н2СО3, Н2SО3).
Якщо виконується хоча б одна з цих умов, реакція відбувається до кінця і є незворотною. Якщо ж ці умови не виконуються, то при змішуванні розчинів утворюється суміш йонів і реакція є зворотною.
Для прогнозування можливості перебігу реакцій йонного обміну в розчинах електролітів слід використовувати таблицю розчинності.
Перегляньте відео !
https://www.youtube.com/watch?v=Wzn5X2_k4tU
Домашнє завдання: опрацювати конспект уроку, ознайомитись з матеріалом підручника п. 11,12. Завдання виконати в робочий зошит.
02.11.2021
Тема: Ступінь дисоціації. Сильні і слабкі електроліти.
Ступінь дисоціації. Сильні і слабкі електроліти
Після вивчення цієї теми ти повинен:
- Давати визначення ступеню дисоціації сильних і слабких електролітів;
- Наводити приклади сильних та слабких електролітів;
- Встановлювати відмінність між сильними і слабкими електролітами;
- Обчислювати ступінь дисоціації.
Кількісним показником електролітичної дисоціації на йони є ступінь дисоціації – α (альфа): 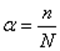 (1)
(1)
де n – кількість дисоційованих молекул на йони; N – загальна кількість молекул, що знаходяться у розчині. Ступінь дисоціації α виражається в частках одиниці, або у відсотках. Тоді формулу (1) треба помножити на 100%.
Наприклад, якщо ступінь дисоціації фторидної кислоти дорівнює 30 %, або 0,3, це означає, що у водному розчині з кожних ста молекул кислоти тридцять розпалися на йони. Або з кожних десяти молекул кислоти три дисоціювали (мал.1):
α(НF) = 0,3(30 %)
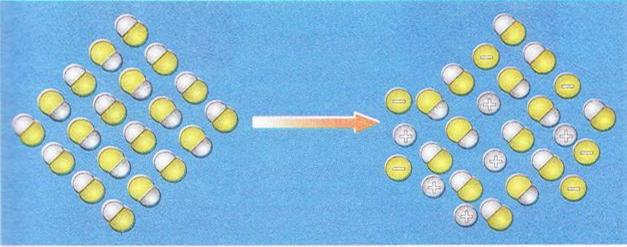
Мал.1. Ступінь дисоціації фторидної кислоти дорівнює 0,3 або 30%,
це означає, що у водному розчині з кожних десяти молекул три дисоціювали
Ступінь дисоціації електролітів визначають експериментально. Він залежить від природи розчинника, природи розчинюваної речовини та її частки у розчині, температури тощо. Чим більша полярність розчинника, тим більший ступінь дисоціації електроліту в ньому. Підвищення температури, як правило, збільшує дисоціацію, тож за нагрівання ступінь дисоціації зростає. У разі зменшення частки електроліту у розчині, тобто під час його розбавляння, ступінь дисоціації збільшується. Тож, зазначаючи ступінь дисоціації, слід зазначати й концентрацію розчину .
З огляду на ступінь дисоціації електроліти поділяють на:
![]() Сильні;
Сильні;
![]() слабкі;
слабкі;
![]() середньої сили.
середньої сили.
Сильні й слабкі електроліти різняться здатністю дисоціювати у водних розчинах. Електроліти, ступінь дисоціації яких навіть у відносно концентрованих розчинах високий (близький до 1), називають сильними, а електроліти, ступінь дисоціації яких навіть у розведених розчинах невеликий, - слабкими.
Сильними електролітами є луги та чи не всі солі. У розбавлених розчинах сульфатна, нітратна, хлоридна, бромідна, йодидна кислоти також дисоціюють практично повністю.
α > 0,3, або 30% то це сильні електроліти (солі, луги, сильні мінеральні кислоти: H2SO4, HNO3, HCl, HI, HF, HClO4, HMnO4);
Мал.2 Сильні й слабкі електроліти
від 3% < α < 30% - електроліти середньої сили (H3PO4, H2SO3, HF);
Тепер вам зрозуміло, що критерієм цієї класифікації є ступінь електролітичної дисоціації кислот, тобто їхня приналежність до сильних чи слабких електролітів.
α < 3% - слабкі електроліти ( H2O, NH4OН - нашатирний спирт, органічні кислоти, H2CO3, H2SiO3, H2S, HNO2, HClO, HCN).
Пригадаймо, слабка карбонатна кислота міститься у газованих напоях (існує у вигляді гідрату С02•Н20). Добре відомі вам з повсякденного життя кислоти - молочна, оцтова, аскорбінова (вітамін С) й ацетил-саліцилова (аспірин) кислоти - слабкі електроліти. Сульфітна, сульфідна, силікатна кислоти (пригадайте їхні хімічні формули, за потреби зверніться до таблиці «Розчинність кислот, основ і солей у воді») також слабкі електроліти. Слабкими електролітами є й гідроксиди металічних елементів (за винятком лугів). Ступінь дисоціації слабких електролітів зазвичай не перевищує 3 %.
У розчинах слабких електролітів одночасно містяться молекули і йони розчиненої речовини. Нагадаємо, що процес дисоціації електролітів оборотний, а у середніх і слабких електролітів він буде ще й ступінчатий. Кожний наступний етап дисоціації буде проходити важче і важче, тому що дія сили притягування в йоні зростає.
I-ша ступінь : H3PO4 ↔ H + + H2PO4![]()
II-га ступінь : H2PO4![]() ↔ H ++ HPO42
↔ H ++ HPO42![]()
III-тя ступінь: HPO42![]() ↔ H ++PO43
↔ H ++PO43![]()
Сумарне рівняння: H3PO4 ↔ 3H+ + PO43![]()
Набуті знання використаймо при розв’язування задач .
Завдання 1. Обчисліть ступінь дисоціації, якщо за температури 20°С у воді розчинилося молекул речовини: 40 із 180 та 4 із 100. Які це електроліти?
Розв’язання
| α = α1 = α2 =
|
Відповідь: α1 = 22%, α2 = 4%. Обидві речовини являються електролітами середньої сили.
Завдання №2.
За температури 18ºС ступінь дисоціації води 1,4 • 10-9. Обчисліть скільки молекул продисоціює на йони в 1л води.
Розв’язання
| 1. Знайдемо масу води, що займає об’єм 700 мл. ρ (H2O) = 1 г/мл m = υ • ρ m (H2O) = 1000 мл • 1 г/ мл = 1000 г 2. Знайдемо кількість молекул води в цій масі υ = υ (Н20) = |
3. Знайдемо число дисоційованих молекул
α = ![]() ; n = α • N; υ =
; n = α • N; υ =![]() ; N = υ • NА
; N = υ • NА
N = 55,55 • 6 • 1023 молекул
n = 1,4 • 10-9 • 55,55 • 6 • 1023 = 466,6 • 1014 ≈ 4,66 • 1016 молекул
Відповідь: n ≈ 4,66 • 1016 молекул.
Домашнє завдання : опрацювати п. 11 підручника
Завдання для самоконтролю:
Успіхів тобі!
1. Вставте пропущені слова.
2. Установіть відповідність між формулою електроліту і йонами, на які цей електроліт дисоціює:
1 | NaOH | А | Ва2+ + 2ОН |
2 | H2SO3 | Б | Na+ + OH |
3 | MgHPO4 | В | Мg 2+ + H+ + PO43 |
4 | Ba(OH)2 | Г | Вa 2+ + OH |
|
| Д | 2H+ + SO32 |
Відповідь вводьте за зразком А5Б4В3Г2
4. Укажіть формули речовин, що належать до сильних електролітів:
а) Н2SiO3; б) NaOH ; в) HCI ;
г) HNO2 ; д) НСІО; е) HNO3 .
5. Позначте формулу речовини, яка під час розчинення у воді утворює йони Ba2+
а) BaO; б) BaSO4; в) BaСl2; г) BaCO3
6. Обчисліть та позначте ступінь дисоціації електроліту, якщо з кожних 80 молекул 18 продисоціювали:
7. Обчисліть та позначте кількість частинок речовини, що продисоціювали із 120, якщо ступінь дисоціації – 40%.
8. Обчисліть та позначте кількість речовини катіонів у розчині, що містить розчинений хром(ІІІ) сульфат кількістю речовини 5,5 моль:
9. Обчисліть та позначте масу аніонів у розчині, що містить розчинений купрум(ІІ) сульфат кількістю речовини 32 моль:
10. Обчисліть та позначте число катіонів у розчині, що містить розчинений ферум(ІІІ) сульфат кількістю речовини 10,5 моль, якщо вважати, що сіль повністю продисоціювала.
а) 125,44 × 10 23; б) 126,42 × 1024; в) 126,84 × 1022; г) 127,42 × 1023 .
Немає коментарів:
Дописати коментар