Хімія 10 клас
https://meet.google.com/yyy-szea-agg - посилання на онлайн-урок (за розкладом)
09.05. 2022 - 13.05.22
Тема: Звязки між класами органічних сполук
Органічні сполуки об’єднує їхнє походження. Тому не дивно, що між ними існують взаємозв’язки і різні можливості взаємоперетворень. Світ органічних речовин не можна відокремити від кожного з нас. У ньому — чимало речовин, важливих для живих організмів. Дедалі більше органічних сполук і матеріалів на їх основі ми використовуємо в повсякденному житті. Досягнення вчених у галузі органічної хімії значною мірою забезпечують розвиток суспільства, дають змогу вирішувати глобальні проблеми цивілізації. Причинами багатоманітності органічних сполук є: • утворення атомами Карбону гомоланцюгів — ланцюгів з атомів одного хімічного елемента. Карбон — унікальний хімічний елемент, що може утворювати енергетично стабільні гомоланцюги. Існують також інші елементи, для яких характерні гомоланцюги, але не настільки стабільні й довгі, як у Карбону; • існування сполук з простими та кратними зв'язками. Можливість утворення подвійного чи потрійного зв'язку в молекулах збільшує число можливих органічних речовин та урізноманітнює класи сполук; • існування ізомерів. Чим більше атомів (однакових чи різних) міститься в молекулі, тим більше існує можливих комбінацій їх сполучення. Так, не всі ізомери можуть існувати тривалий час, і не всі вони матимуть цінність для людини. Але ізомерія — дуже суттєвий чинник, що сприяє урізноманітненню й збільшенню числа органічних сполук; • існування сполук з різними характеристичними групами. Характеристичні групи можуть утворювати атоми майже будь-яких хімічних елементів, навіть металічних, що зумовлює існування 2 величезного числа класів органічних сполук, значно більшого, ніж вивчають у школі; • хімічні реакції в живих організмах. На перший погляд здається, що в живих організмах сполук не так уже й багато (білки, вуглеводи тощо). Але це не так. Наприклад, лише білків існує велика кількість різновидів: майже 20 амінокислот можуть утворювати поліпептидні ланцюги різної довжини, з різним амінокислотним складом, різною їх послідовністю. Це також стосується інших органічних сполук у живих організмах. Отже, число органічних сполук може бути майже нескінченним, і навіть передбачити це число неможливо. Можна тільки сказати, що, за даними хімічної реферативної служби (CAS), на початок 2018 року зареєстровано понад 110 млн органічних сполук і кожного дня синтезують нові.
https://www.youtube.com/watch?v=aIBWdpI-OfA
Д.З. перегляньте відео, опрацюйте матеріал підручника. Повторіть основні класи органічних сполук, підготуйтесь до підсумкової контрольної роботи.
https://meet.google.com/yyy-szea-agg - посилання на онлайн-урок (за розкладом)
02.05. 2022 - 06.05.22
Тема: Вплив полімерних матеріалів на здоров'я людини. проблема утилізації полімерів і пластмас.
Вплив пластмас на здоров'я людини. Ви вже ознайомилися з найпоширенішими пластмасами. Характерно, що серед них домінують економічно вигідні для людини полімерні матеріали, основними властивостями яких є міцність, стійкість до дії зовнішніх чинників, дешевизна, водо- й газонепроникність. Завдяки їм пластмаси набули широкого застосування. Це тара для зберігання багатьох продуктів, канцелярські товари, якими ви користуєтеся на уроках, пляшки під оцет, олію, мінеральні води, соки, фруктові напої, одяг із синтетичних матеріалів тощо. Людина настільки звиклася з полімерними матеріалами, що навіть не замислюється над тим, позитивно чи негативно вони впливають на стан її здоров'я.
Дослідження вчених показали, що певні види пластмас шкідливі для здоров'я дорослих і дітей. Багато речей, які використовують у побуті (зокрема, деякий посуд, пластикові упаковки для харчових продуктів, пляшки із сосками для штучного вигодовування дітей, віконні рами, плівки для натяжних стель, пластикові меблі або елементи меблів, стоматологічні пломбувальні матеріали), містять у своєму складі бісфенол А (дифенілпропан). Згідно з дослідженнями, ця хімічна речовина спричиняє гормональні порушення, негативно впливає на роботу репродуктивної та серцево-судинної систем, призводить до порушення розвитку головного мозку в дітей, пригнічує функції ендокринної системи, сприяє розвитку онкологічних захворювань.
Офіційно вважається, що пластикові пляшки безпечні для здоров'я. Водночас установлено, що в пляшки легко проникають кисень, карбон(IV) оксид, ультрафіолетові промені. Тому багаторазове використання найбезпечніших пластмасових пляшок зумовлює скупчення в них небезпечних мікроорганізмів.
Небезпечними для здоров'я людини є вироби із стирену та полістирену, пластифікатори поліхлоровінілу.
Щоб поводження із синтетичними матеріалами було безпечним, необхідно користуватися маркованням пластмас щодо їх використання й подальшої переробки (утилізації). На деяких пластмасових виробах наявні позначення: трикутник із стрілок, у центрі якого розміщена цифра — від 1 до 7 (рис. 64).

Рис. 64. Марковання пластмас
Пластмаси поділяють на сім груп щодо поліпшення їхньої переробки. За цими знаками визначають, для яких цілей можна використати пластмасовий виріб:
- 1 — поліетилентерефталат (PETE) — найбезпечніший вид пластмас;
- 2 — поліетилен високої щільності (HDPE) — безпечний у користуванні, однак є застереження, що із стінок тари можуть потрапляти в рідину гексан і бензен (інформація не підтверджена);
- 3 — поліхлоровініл (V) — найотруйніший і небезпечний для здоров'я людини вид пластмас. Під час спалювання утворюються високотоксичні хлороорганічні сполуки. Після десяти років використання вироби, виготовлені з цього матеріалу, починають самостійно виділяти в довкілля токсичні сполуки. Неприпустимо виготовлення з нього дитячих іграшок. Уражає центральну нервову й кісткову системи, мозок, серце, печінку, знищує імунну систему, канцероген;
- 4 — поліетилен низької щільності (LDPE) — офіційно вважається нешкідливим, але у виробництві LDPE використовують потенційно небезпечні для здоров'я бутан і бензен;
- 5 — поліпропілен (PP) — офіційно вважається нешкідливим для здоров'я;
- 6 — полістирен (PS) — добувають полімеризацією стирену, який є канцерогеном, уражає слизові оболонки, негативно впливає на репродуктивні функції організму людини;
- 7 — інші види пластмас — до цієї групи належать пластмаси, використання яких може бути пов'язане з небезпекою, а також екологічні види пластмас. Однак, використовуючи вироби з них, людина ризикує.
Тару з відповідним маркованням показано на рис. 65.

Рис. 65. Використання пластмас першої (а) і другої (б) груп та їх марковання
Вплив пластмас на довкілля. Дедалі більший попит на нові синтетичні матеріали, їх виробництво та застосування призвели до істотних змін у довкіллі. Унаслідок синтезу пластмас забруднюється атмосфера, вода, уся земна поверхня
Під час виробництва пластмас в атмосферу потрапляють отруйні гази, пил, сполуки Плюмбуму, Меркурію та деяких інших важких металічних елементів, оксиди Сульфуру, Нітрогену, Карбону (рис. 66). Вони порушують колообіги речовин, що призводить до утворення смогу — туману, який надовго зависає над поверхнею великих міст за високої вологості або спеки (рис. 67).

Рис. 66. Викиди газів в атмосферу

Рис. 67. Смог
Багато технологічних промислових операцій відбувається за участю кисню, який вилучають з повітря, зменшуючи при цьому його вміст в атмосфері Землі.
Отруйні речовини, що потрапляють у повітря, поширюються на великі відстані. Під час дощів розчинні у воді оксиди проникають у ґрунт, підвищуючи його кислотність, а потім — у поверхневі й підземні води. По ланцюгу живлення вони надходять у рослинні й тваринні організми.
Дуже широко застосовують поліетилен у виробництві поліетиленової плівки та як пакувальний матеріал. Після використання він здебільшого накопичується у великій кількості на смітниках, під час повеней потрапляє в річки, моря та океани (рис. 68). Розкладання його відбувається впродовж десятків і сотень років.

Рис. 68. Накопичення відходів пластмас на смітниках (а), у воді (б), на кущах і деревах (в)
Вам уже відомо, що на сміттєзвалищах трапляється самозагоряння сміття, а під час горіння виділяються діоксини та фурани. Вони спричиняють генетичні зміни, викликаючи мутації в рослинному й тваринному світі. Крім того, потрапляючи у води Світового океану, пакувальні пакети призводять до загибелі багатьох видів морських тварин.
Великої шкоди довкіллю завдає спалювання відходів поліхлоровінілу та полістирену, що спричиняє викиди в повітря дуже токсичних діоксинів.
Проблеми утилізації полімерів і пластмас у контексті сталого розвитку суспільства. Утилізація полімерних матеріалів і пластмас — одна з найактуальніших проблем сьогодення. Адже навіть якісні речі, якими користується людина, з часом стають непридатними.
Є різні методи утилізації, проте насамперед важливо: 1) скорочувати обсяги використання пластмас у різних виробничих процесах; 2) застосовувати ефективні методи їх утилізації; 3) використовувати вироби з пластмас як сировину для вторинної переробки; 4) переробляти пластмаси на паливо.
Малоефективний метод — захоронення пластмасових відходів. Адже такі захоронення займають площі, які можуть використовуватися для господарських потреб. Оскільки розкладання полімерних матеріалів у природних умовах відбувається впродовж 150 років, то ці землі довгий час залишаються незадіяними.
Особливо небезпечним є відкрите спалювання пластмас. Спалювання в сміттєспалювальних печах також негативно впливає на навколишнє середовище, тому що з газоподібними викидами в атмосферу потрапляють діоксини. Побічним продуктом згоряння пластмас може бути ціанідна кислота, яка у великих кількостях є смертельною отрутою. Тож важливе значення має використання газо- й пилоочисних споруд. Ефективна також система сухої та вологої очистки в рукавних фільтрах. До того ж позитивний момент — використання тепла.
Щоб правильно утилізовувати відходи пластмас, доцільно сортувати їх згідно з маркованням (рис. 69).

Рис. 69. Сортування сміття (а) і пластмас (б)
Важливим завданням сьогодення є створення полімерів, що розкладаються під дією бактерій, сонячної енергії або повітря. Витрати на створення таких полімерів є значними, тому виробництво полімерів швидкого розкладу обмежене.
У промислових масштабах екологічно та економічно вигідним напрямом є переробка пластмас і повторне їх використання (рециклінг), а отже, з погляду сталого розвитку суспільства, і ресурсозберігальним. З цією метою відкрито пункти прийому пластику на переробку. Вони передбачають обов'язкове сортування сировини за якістю, кольором, ступенем забруднення (рис. 70).

Рис. 70. Сортування сировини
Під час переробки пластикову сировину подрібнюють, спікають або гранулюють. Така пластмаса є вторинною сировиною для переробки на інші вироби: будівельні матеріали, зокрема полістиролбетон (рис. 71), разовий посуд, скатерті, прищіпки, пляшки, відра, труби, ящики, деталі автомашин тощо.

Рис. 71. Полістиролбетон
Економічне значення переробки пластику полягає ще й у тому, що вторинна переробка не потребує розширення виробництва.
Нині головною проблемою людства є проблема гармонійного збалансованого розв'язання екологічного, енерго- й ресурсозбереження. Ідея комплексного збереження природних ресурсів виникла в 1970-і роки й була підтримана міжнародною спільнотою на Стокгольмській конференції ООН з проблем навколишнього середовища. У 1983 р. Комісія ООН з навколишнього середовища та розвитку закликала до нової ери економічного розвитку, безпечного для довкілля, який отримав назву «сталий розвиток». Це такий підхід до життя, коли інтереси суспільства спрямовуються на задоволення потреб не лише нинішнього населення планети Земля, а й наступних поколінь.
Щоб захистити довкілля від шкідливих продуктів хімічних виробництв, у контексті Стратегії сталого розвитку України основними завданнями суспільства, зокрема, визначено такі:
• розвивати господарство з урахуванням збереження живої природи, тобто зберігати системи біорозмаїття, системи збереження життя;
• забезпечувати стале використання відновлюваних ресурсів: повітря, води, ґрунтів, лісів, сільськогосподарських угідь тощо із збереженням здатностей до самовідновлення;
• економно й оптимально використовувати обмежені ресурси та природо-, енерго- й матеріалозберігальні технології, сировинну базу, створюючи екологічно чисту продукцію;
• ефективно очищати гази, що викидаються в атмосферу внаслідок господарської діяльності промислових підприємств, і воду, у яку потрапляють побутові та виробничі відходи;
• зменшувати частку спалювання газу, щоб запобігти парниковому ефекту;
• створювати мало- або безвідходні виробництва, переробляти відходи;
• вести суворий контроль за станом довкілля, прогнозувати його зміни;
• вести просвітницьку роботу щодо збереження довкілля, формувати екологічне мислення та свідоме ставлення до екологічних знань.
Вирішення цих проблем залежить від ініціативності та небайдужості кожної людини, яка мешкає на території України. У цьому полягає головне питання людства: чи збережемо планету для майбутніх поколінь?
Для зменшення загрози навколишньому середовищу в Україні розроблено певні наукові ідеї та винаходи з питань переробки пластмас (рис. 72).

Рис. 72. Обладнання з переробки пластмас
Д.З. опрацювати відеоматеріали, підручник п. 31 - 32
https://meet.google.com/yyy-szea-agg - посилання на онлайн-урок (за розкладом)
25.04. 2022 - 29.04.22
Тема: Синтетичні волокна.
https://www.youtube.com/watch?v=zMDak_-SNd4 - перегляньте відео
Ознайомимося з класифікацією волокон, скориставшись рис.

Рис. Схема класифікації волокон
Характеристика волокон. Залежно від походження волокна поділяють на природні та хімічні.
Природні волокна бувають рослинного й тваринного походження. Це високомолекулярні сполуки, що синтезуються природним шляхом рослинними й тваринними організмами. З волокон рослинного походження на фабриках виготовляють лляні та бавовняні тканини, із шерсті тварин — шерстяні тканини, із коконів тутового шовкопряду — натуральний шовк. Тканини з природних волокон не завдають шкоди здоров'ю людини.
Однак тканин із природних волокон не вистачає, щоб повністю задовольнити попит на них. Тож на допомогу прийшла хімія. Учені використали знання про склад і будову природних полімерів — целюлози й білків, з яких утворені натуральні волокна бавовни й шерсті, і розробили технології виробництва хімічних волокон.
Розрізняють два види хімічних волокон: штучні й синтетичні. Штучні волокна виготовляють переробкою природних полімерних матеріалів.
До синтетичних волокон належать волокна, добуті із синтезованих полімерів. Це такі широко вживані волокна, як капрон, найлон, лавсан.
Капрон у промисловості добувають з епсилон-амінокапронової кислоти реакцією поліконденсації.
Пригадайте, які реакції називають реакціями-поліконденсації.
Капрон належить до поліамідних волокон, бо молекули епсилон-амінокапронової кислоти сполучаються в поліпептидний ланцюг за допомогою пептидних (амідних) зв'язків. Хімічний склад полімеру відображає формула

Капрон — полімер лінійної будови. Капронове волокно дуже міцне, стійке до дії хімічних сполук, а також до розтягування й стирання, еластичне, не вбирає вологу. За зовнішніми ознаками подібний до натурального шовку.
Найлон отримують поліконденсацією двох речовин: гексаметилендіаміну та адипінової кислоти. Хімічний склад відображає формула

За своїми фізичними властивостями найлон дуже подібний до капрону. Добре поєднується з шерстю та бавовною, завдяки чому стає приємним на дотик, а сплетіння ниток утворює різноманітні структури.
Лавсан — поліестерне волокно, яке синтезують реакцією поліконденсації терефталевої кислоти з етиленгліколем. Загальна формула лавсану

Модель макромолекули лавсану зображено на рис.

Рис Кулестержнева модель макромолекули лавсану
Лавсан має високу міцність, пружність. На нього не впливають такі чинники, як світло й тепло, хімічні речовини. За зовнішніми ознаками та властивостями подібний до вовни, але перевершує її міцністю, не мнеться.
Пошуком легкого, але міцного синтетичного волокна займалась і С. Кволек.

Кволек Стефані Луїза (1923-2014) — американська вчена-хімік. Закінчивши коледж, планувала стати лікарем. З 1946 р. працювала в компанії «Du Pont», де серйозно захопилася хімією. Працюючи у фірмі, вона винайшла параамідне синтетичне волокно, у п'ять разів міцніше за сталь. Волокно відоме за назвою «кевлар». Це дало поштовх до створення нового напряму розвитку полімерної хімії. Учена-дослідниця була членкинею Національної академії наук, а також четвертою жінкою, яка була обрана до Національної зали слави винахідників США. Упродовж життя отримала безліч нагород за досягнення в галузі хімії полімерів, зокрема Національну медаль США (1996) за технології.
Застосування синтетичних волокон. Завдяки міцності й стійкості до впливів зовнішніх чинників синтетичні волокна набули широкого застосування. З них виготовляють нитки й тканини для пошиття чоловічого та жіночого одягу, пряжу для трикотажних виробів, кордні тканини. Крім того, з капронового волокна плетуть рибальські сітки, роблять волосінь, фільтрувальні матеріали. З капронової смоли відливають деталі машин і механізмів.
Найлон і лавсан застосовують у текстильній, автомобільній та машинобудівній промисловостях, медицині.
Виробництво синтетичних волокон захоплює науковців усього світу, оскільки використання природної сировини не задовольняє попит на матеріали для одягу. Сучасні тканини відрізняються своїми властивостями, зокрема можуть регулювати потовиділення, дихання та серцебиття, змінювати колір чи візерунок, самоочищатися, нагріватися й охолоджуватися. Це інноваційні матеріали, за якими майбутнє.
Синтетичні волокна використовують і як ізоляційний, ущільнювальний, термостійкий та довговічний матеріал.
Д.З. опрацювати відеоматеріали, підручник п. 34
https://meet.google.com/yyy-szea-agg - посилання на онлайн-урок (за розкладом)
18.04. 2022 - 22.04.22
Тема: Синтетичні високомолекулярні речовини. Полімери. Пласмаси. Каучуки. Гума.
Полімери
В основі створення новітніх матеріалів лежать високомолекулярні сполуки — полімери.
Полімери — природні та штучні сполуки, молекули яких складаються з великого числа повторюваних однакових або різних за будовою атомних угруповань, сполучених між собою в довгі лінійні або розгалужені ланцюги.

Полімеризація — це послідовне сполучення однакових молекул низькомолекулярної речовини з утворенням високомолекулярної речовини.
Поліконденсація — це процес утворення високомолекулярних сполук з низькомолекулярних, що зазвичай супроводжується виділенням побічних речовин (води, амоніаку, хлороводню тощо).
Пластмаси
Пластичними матеріалами називають велику групу матеріалів, що в період переробки у вироби мають пластичні властивості, але за звичайних умов являють собою тверді та пружні речовини.
Пластмаси формують за підвищеної температури, у той час коли вони мають високу пластичність.
Сировиною для отримання полімерів є нафта, природний газ, кам’яне вугілля, сланці.
Поширенню пластмас сприяють їх мала густина, що значно зменшує масу деталей, висока корозійна стійкість, широкий діапазон властивостей. Добрі антифрикційні характеристики багатьох пластмас дають можливість з успіхом застосовувати їх для виготовлення підшипників ковзання. Високий коефіцієнт тертя деяких пластмас дозволяє використовувати їх для гальмових пристроїв. Певні пластмаси мають специфічні властивості: високі електроізоляційні характеристики, велику прозорість та ін.
Важливою перевагою пластмас є можливість їх переробки у вироби найбільш продуктивними способами з коефіцієнтом використання матеріалу 0,9-0,95 — литтям, видавлюванням тощо.
Водночас пластмасам притаманні й деякі недоліки: невисокі міцність, твердість і жорсткість, велика повзучість, особливо у термопластів, низька теплостійкість (більшість пластмас має робочу температуру не вище ніж 200 °С, і лише деякі можуть працювати за 300-400 °С), низька теплопровідність (у 500-600 разів менша, ніж у металів), здатність старіти (втрачати властивості під впливом тепла, світла, води та інших факторів).
Під час старіння зменшується еластичність і міцність пластмас, збільшується їх жорсткість і крихкість. Під еластичністю розуміють здатність матеріалу до великих зворотних деформацій. Цей термін за фізичним сенсом аналогічний пружності, але перший уживають для аморфних, а другий — для кристалічних тіл.
Більшість полімерів перебуває в аморфному (склоподібному) стані. Такі полімери називають смолами. У пластмасах може бути присутньою певна кількість кристалічної фази, яка підвищує міцність, жорсткість і теплостійкість полімеру. У виробництві пластмас використовують в основному синтетичні смоли.
Крім полімерів пластмаси можуть містити наповнювачі, пластифікатори та спеціальні добавки, що надають пластмасі певних властивостей.
Наповнювачами (зміцнювальними компонентами) можуть бути органічні або неорганічні речовини у вигляді порошків (графіт, деревне або кварцове борошно), волокон (паперових, бавовняних, азбестових, скляних) або листів (тканина, папір, деревний шпон). Наповнювачі підвищують міцність, зносостійкість, теплостійкість та інші властивості пластмас. Їх частка у пластмасі може досягати 40-80 %.
Пластифікатори вводять для підвищення пластичності та еластичності пластмас (гліцерин, касторове або парафінове масло).
Добавками можуть бути:
· стабілізатори — речовини, які уповільнюють старіння (сажа, сірчані сполуки, феноли);
· мастильні матеріали — речовини, що усувають прилипання матеріалу до прес-форми, збільшують його текучість, зменшують тертя між частинками композиції (віск, стеарин, олеїнова кислота);
· барвники — речовини, що надають пластмасовим виробам декоративного вигляду (охра та ін.);
· каталізатори — речовини, що прискорюють твердіння пластмаси (уротропін, оксиди металів);
· антипірени — речовини, які зменшують горючість полімерів (наприклад, сполуки сурми);
· антистатики — речовини, які перешкоджають виникненню і накопиченню статичного електричного заряду у виробах з полімерних матеріалів;
· пороутворювачі — речовини, які розпадаються під час нагрівання, виділяючи гази, що спінюють смолу, внаслідок чого утворюються поро- та пінопласти з пористою структурою.
Залежно від властивостей смоли пластмаси поділяють на термопластичні й термореактивні.
Термопластичні пластмаси (термопласти) — це такі, що під час нагріву розм’якшуються, переходять у в’язкотекучий стан, а під час охолодженнія твердіють, і цей процес повторюється в разі повторного нагрівання. Тобто такі пластмаси допускають повторну переробку. Зазвичай їх робоча температура не перевищує 90 °С.
Термореактивні пластмаси (реактопласти), нагріваючись, розм’якшуються, але за певної температури відбувається полімеризація, внаслідок якої смола переходить у твердий стан і повторна переробка таких пластмас неможлива. Теплостійкість їх вища до 200-370 °С.
Каучуки
Каучуки — це еластичні матеріали, з яких методом вулканізації (нагріванням із сіркою) дістають гуму. Каучуки бувають природними та синтетичними.
Натуральний (природний) каучук за хімічним складом є високомолекулярним ненасиченим вуглеводнем складу, де n становить від 1000 до 3000. Натуральний каучук — полімер ізопрену

Його одержують із молочного соку каучуконосних рослин, головним чином із гевеї (Бразилія). Бразилія — батьківщина каучуку.
Синтетичні каучуки дістали досить широке застосування. Номенклатура гумових виробів на основі синтетичного каучуку налічує близько 50 000 назв. Найбільше синтетичних каучуків використовує шинна промисловість, машинобудівна (виготовлення деталей для автомобілів, тракторів та інших машин). Широко використовують синтетичні каучуки для виробництва технічних виробів, гумового взуття, прогумованих тканин, побутових гумових виробів, медичних товарів та ін. В електротехніці використовують каучуки для ізоляції проводів і оболонок кабелів. Рідкі каучуки застосовують для виготовлення клеїв, антикорозійних матеріалів, як зв’язуючу речовину для виготовлення твердого ракетного палива.
Гума
Гума — це вулканізований сіркою каучук. Суть вулканізації полягає в тому, що атоми Сульфуру приєднуються до лінійних (ниткоподібних) молекул каучуку за місцем подвійних зв’язків і неначе зшивають ці молекули одну з одною. У результаті вулканізації липкий і неміцний каучук перетворюється на пружну й еластичну гуму. Гума міцніша за каучук і стійкіша до змін температури.
Згідно із загальноприйнятою класифікацією, гумотехнічна галузь промисловості випускає такі види гуми:
· загального призначення (температура експлуатації Q = -50...+150 °С — шини автомобільні, взуття, ремені, амортизатори);
· термостійкі (температура експлуатації більше 150 °С — шини літаків, деталі ракет, електродвигунів);
· маслостійкі (для деталей, які працюють з дотиком до бензину, гасу, нафти та нафтопродуктів);
· хімічностійкі (для деталей, які працюють з дотиком до лугів, кислот, солей);
· газонаповнені (для теплоізоляційних деталей);
· радіостійкі (рентгенгума);
· діелектричні (ізоляція кабелю, захисні килимки, рукавиці, чоботи).
Той чи інший вид гуми отримують, в основному, за рахунок відповідних інгредієнтів, а також за рахунок технологічних особливостей.
Технологія виготовлення гуми складається з чотирьох стадій:
· різання каучуку на шматки і приготування інгредієнтів (подрібнення, просіювання, сортування, зважування);
· приготування гумової суміші в герметичних гумозмішувачах і на каландрах (валках);
· формування (на валках для листової гуми або в пресформах для штучних виробів);
· вулканізація — завершальна і дуже відповідальна операція, яка може відбуватися в пресах, котлах і автоклавах за температури 130-160 °С і тиску 18-20 МПа, але може відбуватись і за тиску 3-6 МПа. Існує також вулканізація з використанням високочастотних коливань та радіації. Якість гуми про цьому покращується, але цей спосіб занадто дорогий.
Під час вулканізації сірка з’єднується з молекулами каучуку, зшиваючи їх у тримірну структуру, яка називається гумою. Саме під час вулканізації гума набуває основної якості — можливості подовжуватись.
МАТЕРІАЛИ ДО УРОКУ
Полівінілхлорид — [-CH2 - CHCl-]n
Термопластичний. Під час нагрівання розм’якшується. Горить невеликим полум’ям, створюючи чорну тендітну кульку. Під час горіння відчувається гострий запах. Досить міцний, має гарні діелектричні властивості. Обмежено розчинний у кетонах, естерах, хлорованих вуглеводнів. Стійкий до дії вологи, кислот, лугів, розчинів солей, промислових газів, бензину, гасу, жирів, спиртів. Стійкий до окиснення й практично негорючий, має невисоку теплостійкість. Застосовується для виробництва штучної шкіри, плащів, клейонки, труб, ізоляційного матеріалу для електричних проводів, будматеріалів.
Поліетилен (етиленопласт) — [-CH2 - CH2-]n
Поліетилен за кімнатної температури не розчиняється в жодному розчиннику. Зовні схожий на парафін, але значно твердіший. Поліетилен легкий, не набрякає у воді й порівняно з іншими пластмасами добрий діелектрик та високоеластичний. Застосовують його для виготовлення плівки для парників, теплиць та різних галантерейних виробів — сумок, кошиків, скатертин тощо.
Поліакрилати, або акрилопласти (органічне скло, плексиглас) — дуже поширена прозора пластмаса, з якої виготовляють найрізноманітніші вироби — посуд, чорнильниці, ручки, скло для годинників, шибки для ілюмінаторів літаків тощо. Вона не б’ється і пропускає 73 % ультрафіолетового проміння, якого звичайне скло зовсім не пропускає. Недоліком є те, що ця пластмаса недостатньо тверда; на ній швидко утворюються подряпини. Органічне скло добре обробляти різальним інструментом, шліфувати і полірувати. Його можна фарбувати в різні кольори органічними барвниками. Плексиглас під час нагрівання розм’якає, а в полум’ї загоряється.
Полістирол (етилопласт) — [-CH(C6H5)-CH2-]n
Полістирол — безбарвна, досить тверда пластична пластмаса, яка деформується вже за температури 70-90 °С. Вона досить стійка проти дії вологи і мінеральних кислот, проте від їдких лугів руйнується, а в бензені розчиняється. Її добре обробляти інструментом, можна фарбувати. Це одна з найпоширеніших пластмас, з якої виробляють найрізноманітніші вироби — галантерейні товари, посуд, що імітує кришталь, деталі радіоапаратури тощо. У разі внесення в полум’я пальника полістирол горить, виділяючи ефірний запах, а коли його погасити і доторкнутися до нього, то тягнутимуться нитки.
Поліамід (амідопласт) у чистому вигляді безбарвний, але добре фарбується в різні кольори. З нього виготовляють волокно (капрон, нейлон для панчіх і тканини, а останнім часом також виготовляють водяні крани, шестірні, втулки тощо). Під час горіння капрон виділяє запах горілих овочів. Тканини з капрону не можна прасувати гарячою праскою, бо за температури 215 °С він плавиться.
Целулоїд, ацетилцелюлоза — матеріал для виготовлення галантерейних виробів, іграшок та інших. Целулоїд — легкозаймистий. Ацетилцелюлоза на відміну від нього малозаймиста, а пластмаса — целон, яку виготовляють з неї, у полум’ї не займається, через що її часто називають негорючим целулоїдом. Целулоїдні пластмаси під час тертя об шерсть виділяють запах камфори.
Фторопласт — зовні схожий на парафін. Має високу хімічну стійкість, що перевищує стійкість золота і платини. Фторопласт не горить, а лише плавиться.
Поліпропілен — [-CH2 - CH(CH3)-]n
Термопластичний. Має властивості високої ударної міцності, високої стійкості до багаторазових вигинів, низьку паропроникність і газопроникність; гарний діелектрик, погано проводить тепло, не розчиняється в органічних розчинниках, стійкий до впливу киплячої води й лугів, але темніє й руйнується під дією HNO3, H2SO4 і хромової суміші. Має низьку термостійкість і світлостійкість. Із пропілену виготовляють волокна й плівки, що зберігають гнучкість за 100-1300 °С, пінопласт, деталі машин, профільовані вироби, труби, різну арматури, контейнери, побутові вироби та ін.
Текстоліт — електроізоляційний конструкційний матеріал, який застосовується для виробництва підшипників ковзання, шестерень та інших деталей, а також в електро- і радіотехніці. Являє собою шаруватий пластик на основі тканини з волокон і полімерного сполучного речовини (наприклад, епоксидної смоли). Текстоліт на основі склотканини називається склотекстолітом, або склопластиком.
Вініпласт — жорстка термопластична непрозора, що не містить пластифікатори, пластична маса на основі полівінілхлориду та перхлорвінілової смоли. Містить також термо- і світлостабілізатори, антиоксиданти, що запобігають руйнуванню матеріалу під час переробки та експлуатації, змащувальні речовини (полегшують його обробку та переробку), пігменти або барвники (для одержання кольорових виробів).
Гетинакс — шаруватий пластик на основі паперу й синтетичних смол. Іноді гетинакс фольгують червоно-мідною електролітичною фольгою, облицьовують бавовняними, скляними або азбестовими тканинами, армують металевою сіткою. Залежно від призначення гетинаксу випускають декількох марок. Гетинакс має високу механічну міцність, гарні електроізоляційні властивості. Гетинакс застосовують як електроізоляційний матеріал для тривалої роботи за температур від -65 до +105 °С; для виробництва панелей, кришок, втулок, шестірень, шайб та ін., а також у меблевому виробництві. З фольгованого гетинаксу виготовляють друковані схеми.
https://www.youtube.com/watch?v=xSMksk2rxJ0 - перегляньте відео про каучук і гуму
Д.З. опрацювати відеоматеріали, підручник п. 30 - 33
https://meet.google.com/yyy-szea-agg - посилання на онлайн-урок (за розкладом)
11.04. 2022 - 15.04.22
Тема: Амінокислоти: склад, будова молекули, властивості. Білки, їх властивості
• Амінокислоти — органічні сполуки, до складу молекул яких входять аміногрупи -NH2 й карбоксильні групи -COOH.
Будову найпростішої амінокислоти розглядають як похідну етанової кислоти, у молекулі якої один атом Гідрогену заміщений на аміногрупу (рис. 48).

Рис. 48. Масштабна модель молекули аміноетанової кислоти
Молекула аміноетанової кислоти містить у своєму складі одну аміногрупу й одну карбоксильну. Практично ця речовина проявляє амфотерні властивості: основні, що є характерними для аміногрупи, та кислотні, властиві карбоксильній групі. Однак за складом молекули амінокислот дуже різні, вони можуть містити різну кількість аміногруп і карбоксильних груп. Крім того, у деяких амінокислот наявні гідроксильні -ОН, сульфідні -S-, фенільні С6Н5- групи. Зрозуміло, що зі зміною складу змінюється будова, а відтак, і властивості цих сполук.
Український хімік і біохімік І. Горбачевський уперше висловив думку про те, що до складу білкових молекул входять амінокислоти. Згодом (1902 р.) німецький хімік-органік і біохімік Е. Г. Фішер, який досліджував білки та продукти їхнього розщеплення, установив, що до складу білків входять залишки молекул α-амінокислот. Це амінокислоти, у молекулах яких аміногрупа розміщена біля першого від карбоксильної групи атома Карбону. Загальну формулу α-амінокислот зображено на рис. 49.

Рис. 49. Модель загальної формули молекул α-амінокислот
Структурні формули, що відображають склад молекул і розміщення характеристичних (функціональних) груп деяких амінокислот, а також їхні систематичні й тривіальні назви наведено в табл. 14.
Таблиця 14
Назви амінокислот за систематичною та тривіальною номенклатурами

Кулестержневі моделі деяких амінокислот зображено на рис. 50.

Рис. 50. Кулестержневі моделі: а — 2-амінопропанової кислоти (аланін); б — 2-аміно-3-гідроксипропанової кислоти (серин)
Номенклатура амінокислот. За систематичною номенклатурою назви амінокислот утворюють за таким алгоритмом:
![]()
Наприклад, H2N-CH2-CH2-CH2-COOH — це 4-амінобутанова кислота.
Для складання назв ізомерів: 1) нумеруємо найдовший карбоновий ланцюг, починаючи з атома Карбону в карбоксильній групі; 2) перед назвою позначаємо цифрою положення аміногрупи та інших замісників в алфавітному порядку; 3) додаємо назву кислоти із суфіксом -ова та слово кислота. Наприклад:

Хімічні властивості аміноетанової кислоти. Амінокислоти — амфотерні речовини, тобто сполуки, що проявляють властивості кислот та основ.
Дія на індикатори. Наявність карбоксильної групи в молекулах амінокислот має виявляти кислотне середовище. Так само наявність аміногрупи — лужне. Якщо ж у молекулі речовини є однакова кількість цих груп, то вони нейтралізують одна одну, тому індикатори не змінюють забарвлення. Якщо в складі молекули амінокислоти є дві карбоксильні групи й одна аміногрупа, то індикатори виявляють кислотну реакцію. Якщо переважають аміногрупи — лужну.
Взаємодія з лугами. Як кислоти, амінокислоти реагують з лугами з утворенням солей. Наприклад, запишемо рівняння реакції взаємодії аміноетанової кислоти з натрій гідроксидом:
![]()
Взаємодія з кислотами. Реакції з кислотами відбуваються внаслідок наявності в молекулах амінокислот аміногрупи з утворенням солі. Рівняння реакції:
![]()
Утворення пептидів. Унаслідок взаємодії аміногрупи з карбоксильною різних молекул амінокислот утворюються пептиди:

Утворена речовина — дипептид. Якщо взаємодіють три молекули амінокислот, утворюється трипептид і т. д. Якщо ж за допомогою пептидних зв'язків сполучаються багато амінокислот, утворюються поліпептиди. Вони можуть містити майже 100 амінокислотних залишків.
Різноманітність пептидів залежить від того, які амінокислоти входять до їхнього складу. Реакції взаємодії зворотні, тому пептиди гідролізують за наявності сильної кислоти й під дією нагрівання. Утворення поліпептидів є основою природного процесу синтезу білків.
Біологічна роль амінокислот. Амінокислоти виконують важливі для організму функції. Передусім вони є «цеглинами», з яких побудована велика різноманітність білкових молекул. До складу білків входять 20 α-амінокислот, з яких 8 кислот незамінні, тобто такі, що їх не синтезують організми тварин і людини. Тому, щоб задовольнити потреби людського організму в цих амінокислотах, вони мають надходити до нього з продуктами харчування рослинного та тваринного походження.
Амінокислоти також є добрим енергетичним матеріалом. Наприклад, для підтримки організму людини, виснаженої важкою недугою, іноді вводять амінокислоти безпосередньо в кров. Тим самим полегшується їхнє засвоєння. У разі простудних захворювань ефективним профілактичним і лікувальним засобом є афлубін, що активізує імунні сили організму.
Амінокислоти необхідні не тільки людям. Їх застосовують як корм для відгодівлі сільськогосподарських тварин.
https://www.youtube.com/watch?v=kgPNNXQ89u0 - перегляньте відео
https://www.youtube.com/watch?v=g4fzkfFTHNI - перегляньте відео про білки
Д.З. опрацювати матеріали, підручник п.28-29
https://meet.google.com/yyy-szea-agg - посилання на онлайн-урок (за розкладом)
04.04. 2022 - 08.04.22
Тема: Аміни. Анілін.
ПОНЯТТЯ ПРО АМІНИ, ЇХ СКЛАД І БУДОВУ. За якісним складом — це нітрогеновмісні органічні сполуки, молекули яких містять атоми Карбону, Гідрогену й Нітрогену. Карбон входить до складу вуглеводневого залишку, Нітроген — до складу характеристичної аміногрупи —NH2, Гідроген — до обох складових частин молекули. Назва «аміни» утворена від назви «амоніак». Цей клас сполук розглядають як похідні амоніаку NH3, у молекулі якого один, два або три атоми Гідрогену заміщені вуглеводневими залишками, наприклад, метанамін СН3—NH2, метилметанамін (СН3)2 — NH, диметилметанамін (СН3)3 — N. У всіх амінів, подібно до амоніаку, в атома Нітрогену є вільна електронна пара.
![]()
Завдяки вільній електронній парі аміни вступають у реакції з водою й кислотами.
Аміни — нітрогеновмісні органічні речовини, похідні амоніаку, молекули яких складаються з вуглеводневого залишку й характеристичної аміногрупи —NH2.
У разі наявності в молекулі аміну двох вуглеводневих залишків, у складі характеристичної групи залишається один атом Гідрогену. Якщо вуглеводневих залишків три, то Гідроген у характеристичній групі відсутній.
КЛАСИФІКАЦІЇ Й ЗАГАЛЬНІ ФОРМУЛИ АМІНІВ. Залежно від природи вуглеводневих замісників розрізняють насичені аміни (аміногрупа сполучена із залишком алкану) й ароматичні аміни (аміногрупа сполучена із залишком арену), наприклад:

Кількість вуглеводневих залишків у молекулі служить ще однією класифікаційною характеристикою амінів, за якою їх поділяють на первинні, вторинні й третинні:

Зображені формули є загальними формулами насичених амінів.
НОМЕНКЛАТУРА НАСИЧЕНИХ ПЕРВИННИХ АМІНІВ, ІЗОМЕРІЯ. За систематичною номенклатурою назва аміну складається з одного слова. Воно починається з повної назви відповідного алкану, а до неї додається назва класу сполук «амін». Наприклад:
CH3NH2 — метанамін;
CH3CH2NH2 — етанамін.
Для того щоб назвати насичений первинний амін з розгалуженим вуглеводневим замісником, дотримуються таких правил.
1. Обирають головний (найдовший) карбоновий ланцюг, у якому один з атомів Карбону сполучений з аміногрупою.
2. Нумерують головний ланцюг за принципом найменшого локанта аміногрупи.
3. З'ясовують наявність у головному ланцюзі вуглеводневих замісників і їх назви.
4. Складають назву речовини в такій послідовності:
- називають в алфавітному порядку вуглеводневі замісники (у разі їх наявності в головному ланцюзі), указуючи перед назвами їх локанти, які виділяють дефісами. До однакових замісників уживають множинні префікси ди-, три-, тетра-;
- називають алкан головного ланцюга;
- після назви головного ланцюга записують, виділяючи з обох боків дефісами, локант аміногрупи;
- додають назву класу цих сполук — «амін».
Наприклад, за систематичною номенклатурою амін зі структурною формулою

має назву 3-етил-4-метилгексан-1-амін.
Попрацюйте групами
1. Опануйте правила номенклатури насичених первинних амінів, скориставшись розглянутою вище структурною формулою аміну та його назвою.
2. Назвіть амін, формула якого:

3. Складіть формулу 4,5-диметил-3-пропілоктан-2-аміну.
Вторинні й третинні аміни симетричної будови прийнято називати так:

ІЗОМЕРІЯ НАСИЧЕНИХ ПЕРВИННИХ АМІНІВ. Як ви вже зрозуміли з виконаних у групі завдань, номенклатура цих сполук залежить від будови карбонового ланцюга та місця розташування аміногрупи. Закономірно, що аміни мають більше ізомерів, ніж відповідні їм алкани. Наприклад, у бутану один ізомер, у бутанаміну — три.
Складіть самостійно формули ізомерних амінів бутанаміну.
ФІЗИЧНІ ВЛАСТИВОСТІ ДЕЯКИХ АМІНІВ. За звичайних умов метанамін, метилметанамін і диметилметанамін — гази із запахом амоніаку. Аміни з умістом атомів Карбону С4 - С15 — рідини із запахом оселедцю, решта — тверді речовини без запаху.
ХІМІЧНІ ВЛАСТИВОСТІ НАСИЧЕНИХ АМІНІВ НА ПРИКЛАДІ МЕТАНАМІНУ.
1. Горіння амінів. Аміни згорають у повітрі з утворенням азоту, карбон(IV) оксиду та води:
4CH3NH2 + 9O2 → 4CO2 + 10H2O + 2N2
2. Взаємодія з водою. Подібно до амоніаку, розчинні у воді аміни виявляють основні властивості. Так, під час реакції з водою до аміну приєднується протон Н+ і вивільнюється аніон ОН-, утворений унаслідок електролітичної дисоціації води. Це відбувається за рахунок вільної електронної пари атома Нітрогену:

Варто зазначити, що метанамін є сильнішою основою, ніж амоній гідроксид NH4OH. І в цьому разі підтверджується положення теорії будови органічних сполук про взаємний вплив атомів і груп атомів у молекулі.
3. Взаємодія з хлоридною кислотою. Ця взаємодія також базується на приєднанні протону від кислоти до вільної пари електронів атома Нітрогену:

Метанамоній хлорид належить до солей.
Водні розчини амінів містять у надлишку гідроксид-аніони ОН- і мають лужне середовище. Завдяки цьому та здатності утворювати солі з неорганічними кислотами їх називають органічними основами.
Властивості амінів як основ залежать від природи вуглеводневого залишку. Насичені первинні аміни — найсильніші основи серед амінів.
АНІЛІН, АБО ФЕНІЛАМІН. Це ароматичний амін з молекулярною формулою C6H5NH2.
Його називають феніламін за назвою замісника —С6Н5. Молекулярна формула цієї речовини вказує на те, що аміногрупа сполучена з атомом Карбону бензенового кільця (у бензені відбулася заміна одного атома Гідрогену на одновалентну аміногрупу).
Анілін (мал. 34) — безбарвна (темніє на світлі й у повітрі) оліїста речовина, що важко розчиняється у воді, має специфічний запах. Пари аніліну отруйні.

Мал. 34. Анілін
ХІМІЧНІ ВЛАСТИВОСТІ АНІЛІНУ. Порівняно з метанаміном анілін дуже слабка основа, що не діє на індикатори.
Для аніліну характерні дві групи реакцій: за участю аміногрупи (приклад 1) і за участю бензенового кільця (приклад 2).
1. Взаємодія аніліну з хлоридною кислотою.
![]()
2. Взаємодія аніліну з бромною водою. Вам відомо, що бензен не реагує з бромною водою. Але подібно до фенолу анілін за участю бензенового кільця вступає в реакцію заміщення з бромною водою, внаслідок чого утворюється 2,4,6-трибромоанілін (2,4,6-трибромофеніламін) — жовтувато-білий осад (мал. 35).

Мал. 35. Ілюстрація взаємодії аніліну з бромною водою
Заміщення Гідрогену бензенового кільця в трьох положеннях є результатом впливу аміногрупи на бензенове кільце.
ДОБУВАННЯ АНІЛІНУ. У промисловості анілін добувають відновленням нітробензену С6Н5 — NO2 за допомогою водню у присутності нікелевого чи мідного каталізаторів за нагрівання:
![]()
Нітробензен добувають з бензену. Нижче наведено схему цих перетворень:

ЗАСТОСУВАННЯ АНІЛІНУ. Понад 150 років анілін виробляють у великій кількості, тому що ця речовина — основа синтезу анілінових барвників, які використовують для фарбування тканин у різні яскраві кольори (мал. 36).

Мал. 36. Анілінові барвники
Анілінові барвники можна придбати у вигляді порошку або рідини й за потреби використати в домашніх умовах.
Водночас у разі перевищення допустимих норм використання, вплив аніліну та його похідних для довкілля негативний.
Анілін — сировина для синтезу ліків, наприклад стрептоциду, який має ефективну антимікробну дію; фунгіцидів (препаратів для боротьби з грибковими захворюваннями рослин) та ін.
Стисло про основне
• Аміни — похідні амоніаку, у молекулах яких атоми Гідрогену заміщені вуглеводневими залишками.
• Аміногрупа NH2 — характеристична група амінів.
• Залежно від замісника аміни бувають насиченими й ароматичними, а від кількості заміщених в амоніаці атомів Гідрогену — первинні, вторинні й третинні.
• Водні розчини амінів мають лужну реакцію і взаємодіють з неорганічними кислотами. Через це їх ще називають органічними основами.
• Анілін — ароматичний амін. Взаємний вплив бензенового кільця й аміногрупи виявляється в тому, що ця речовина взаємодіє з бромною водою, відбувається заміщенням трьох атомів Гідрогену з утворенням 2,4,6-трибромофеніламіну.
• Анілін у великих кількостях виробляють з нітробензену (його одержують з бензену) й використовують у виробництві барвників, лікарських засобів тощо.
Д.З. опрацювати матеріали, підручник п.26-27
11.02. 2022
Тема:Жири як представники естерів. Класифікація жирів,їхні хімічні властивості.
Жири поряд з вуглеводами й білками є коштовним харчовим продуктом. Для здорового організму людини добова потреба жиру становить 70-100 г. Зі збільшенням віку й зменшенням фізичного навантаження споживання жирів повинне бути знижене, тому що надлишок жирів в організмі людини є однією з основних причин багатьох захворювань, зокрема, особливо серцевосудинних. В організмі людини основна функція жиру – бути джерелом енергії. Окиснення 1г жиру спричиняє виділенню 39 кДж енергії. Однак буде нерозумним прагнути забезпечити свій організм виключно жирами, оскільки, незважаючи на те, що вони багаті на енергію, жири важко засвоюються. Але не можна забувати, що надлишкова кількість жиру, навіть у раціоні здорової людини, дуже шкідлива. Жири не розчиняються ані водою, ані травними соками. В організмі вони розщеплюються й емульгуються за сприяння жовчі. Зайва кількість жиру не встигає проемульгуватися, порушує травні процеси та спричиняє неприємне відчуття печії. Жири є не тільки джерелом енергії в організмі, а й джерелом води. Завдяки цій воді живуть верблюди тривалий час без свіжої води. Для розвитку зародка курчати в інкубаційний період потрібна вода, а надходження її ззовні відсутнє. Зародок забезпечується водою окисленого жиру. Жири необхідні й мешканцям холодного клімату: тюленям, моржам. Підшкірний жир допомагає зберегти внутрішнє тепло. Будь – якій тварині жирові відкладення пом’якшують силу різних поштовхів і ударів. Крім того, жири для тварин – мастильний матеріал. Відомо, водоплавні птахи самі проводять змащення під час чищення пір’я. Висока харчова цінність жирів зумовлена також розчинністю в них деяких вітамінів А, Д, Е. Жири за походженням Жири тваринні жири рослинні жири, олії ( яловичий жир,свиняче сало, вершкове масло) У 1854 році М. Бертло уперше синтезував жир. Він нагрівав гліцерин з вищою карбоновою кислотою у запаяній посудині. Записуємо хімічне рівняння. Перед вами формула жиру у загальному вигляді. R1, R2, R3 – вуглеводневі залишки (як правило різні, але можуть бути однаковими). Жири утворюють такі насичені кислоти як пальмітинова С15H31COOH, стеаринова C17H35COOH, ненасичена олеїнова C17H33COOН. Для рідких жирів характерні реакції гідрування, тобто приєднання водню за положенням подвійних зв'язків. Під час гідрування речовина перетворюється на сполуку насиченого складу, рідкий жир — на твердий: У такий спосіб виробляють відомий вам харчовий продукт — маргарин. Жири вступають у реакції гідролізу, тобто реагують із водою з утворенням гліцеролу та відповідних вищих карбонових кислот. Під час реакцій гідролізу жирів за наявності лугів утворюються гліцерол і солі вищих карбонових кислот — мила. Зокрема, натрієві солі — це тверде мило, калієві — рідке. Схема реакції: Реакції лужного гідролізу називають омиленням.
Жири — естери гліцеролу і вищих карбонових кислот.
Ці сполуки ще називають тригліцеридами, оскільки молекула жиру містить три кислотні залишки (мал. 55).

Мал. 55. Модель молекули тригліцериду
Загальна формула жирів —

де R, R', R" — вуглеводневі залишки молекул різних кислот.
Природні жири є похідними вищих (жирних) карбонових кислот, молекули яких, як правило, мають нерозгалужену будову і парну кількість атомів Карбону. Серед цих кислот:
• пальмітинова С15Н31СООН, або СН3-(СН2)14-СООН;
• стеаринова С17Н35СООН, або СН3-(СН2)16-СООН;
• олеїнова С17Н33СООН, або СН3-(СН2)7-СН=СН-(СН2)7-СООН;
• лінолева С17Н31СООН, або СН3-(СН2)4-СН=СН-СН2-СН=СН- -(СН2)7-СООН;
Класифікація. Розрізняють тваринні й рослинні жири.
Серед тваринних жирів найбільш уживані вершкове масло, свиняче сало і яловичий жир. У їхньому складі переважають тригліцериди насичених кислот — стеаринової та пальмітинової. Жири морських ссавців і риб утворені переважно ненасиченими жирними кислотами; молекули деяких кислот містять 4 і більше подвійних зв’язків.
Рослинні жири, як вам відомо, називають оліями. Найважливіші олії — соняшникова, оливкова (мал. 56), кукурудзяна. Вони містять переважно тригліцериди ненасичених кислот — олеїнової та лінолевої. Однак у кокосовому і пальмовому жирах найбільше естерів насичених кислот.

Мал. 56. Популярні олії — оливкова і соняшникова
Фізичні властивості. Більшість тваринних жирів є твердими речовинами, а в організмах морських ссавців і риб містяться рідкі жири. Рослинні жири, за винятком кокосового і пальмового, — рідини.
Жир не має сталої температури плавлення, оскільки є сумішшю різних тригліцеридів; він плавиться в певному температурному інтервалі.
Жири легші за воду, нерозчинні в ній, але добре розчиняються в бензині, бензені, дихлороетані та багатьох інших органічних розчинниках. Деякі розчинники використовують при чищенні тканин від жирових плям.
Рідкі жири утворюють з водою емульсії. Приклад такої емульсії — сильно струшена суміш олії з водою, яка швидко розшаровується. Досить стійкою емульсією є молоко.
Хімічні властивості. Із повсякденного життя вам відомо, що жири з часом гіркнуть (це — результат їх окиснення), а за сильного нагрівання розкладаються.
Жири, як і естери одноатомних спиртів, за певних умов зазнають гідролізу, а ті, в молекулах яких є залишки ненасичених кислот, сполучаються з воднем, галогенами (мал. 57).

Мал. 57. Взаємодія соняшникової олії з бромною водою
Гідроліз жирів — один із важливих промислових процесів. Жири взаємодіють із водяною парою за температури 200—250 °С і тиску 20—25 атм або за наявності каталізаторів:

Якщо ці реакції здійснювати за нагрівання й наявності лугів, то замість вищих кислот утворюються їхні солі (мила). Відповідний процес називають омиленням жирів.
Складіть рівняння реакції тристеарину з натрій гідроксидом.
Гідроліз жирів відбувається і в живих організмах. У ньому беруть участь особливі каталізатори — ферменти (с. 216).
Гідрування. Жири, які походять від ненасичених кислот, вступають у реакції, характерні для алкенів, зокрема сполучаються з воднем. При пропусканні газу в нагріту до 160—240 °С олію за наявності каталізатора поступово утворюється твердий жир, схожий на тваринний:

Змішуванням добутого твердого жиру з молоком, вершковим маслом, невеликими кількостями вітамінів А і D виробляють маргарин. Твердий жир також використовують для технічних потреб, як сировину для виробництва мила.
Цікаво знати
Для запобігання появі прогірклості харчових жирів до них додають антиоксиданти.
Окиснення. Контактуючи з вологим повітрям, жири зазнають гідролізу й окиснюються. Продуктами цих перетворень є альдегіди, інші сполуки з меншою кількістю атомів Карбону в молекулах. Більшість із них має неприємний запах і гіркий смак.
Ненасичені жири окиснюються калій перманганатом, іншими окисниками. Цей процес повільно відбувається й за участю кисню повітря; у результаті рослинні жири тверднуть (ніби висихають).
При підпалюванні жири горять на повітрі.
Застосування. Основна сфера використання жирів — харчова промисловість. Ці речовини застосовують у виробництві косметичних засобів, медицині, техніці. Із жирів добувають гліцерин, вищі карбонові кислоти, мило, інші речовини.
Біологічна роль. При повному окисненні жиру в організмі виділяється удвічі більше енергії, ніж із такої самої маси білка чи вуглеводу. Жири містяться в клітинних мембранах, є теплоізоляторами, розчиняють деякі вітаміни.
Олії — джерело ненасичених кислот, які в організмі не утворюються, але мають високу біологічну активність.
https://www.youtube.com/watch?v=PIpkT_MZcz8
Домашнє завдання: перегляньте відео, матеріали підручника п.22
07.02.2022.
Тема: Естери, загальна та структурні формули, номенклатура, фізичні властивості. Гідроліз естерів.
Естери — це похідні оксигеновмісних кислот, у яких гідроксогрупи кислоти заміщені залишками спирту. Загальна формула естерів органічних кислот:
![]()
де R, R' — карбонові радикали.
2. Класифікація. Розрізняють естери органічних та мінеральних кислот (нітратної, сульфатної ортофосфатної тощо).
3. Номенклатура. Вживають іще таку загальну назву естерів — складні ефіри. Назви естерів походять від назв кислот і спиртів. Так, естер з формулою ![]() буде мати такі назви:
буде мати такі назви:
· етилметаноат - сучасна назва;
· етилформіат;
· етиловий ефір форміатної (мурашиної, метанової) кислоти;
· мурашиноетиловий ефір.
Останні 3 назви застаріли, однак трапляються у хімічній літературі.
Естери з формулами C2H5 - O - SO3H і C2H5 - O - SO2 - O - C2H5 — етилгідрогенсульфат і діетилсульфат і т. д.
4. Ізомерія. Для естерів характерна ізомерія вуглеводневих радикалів, а також міжкласова — з карбоновими кислотами. Так, ізомером етилетаноату ![]() є бутанова кислота C3H7 - COOH.
є бутанова кислота C3H7 - COOH.
5. Будова молекули. Молекули етерів складаються з двох структурних елементів — радикалів кислоти та спирту. Атом Оксигену, що їх з’єднує, походить від спирту.
6. Поширення в природі. Естери дуже поширені в природі. Багато з них входить до складу ефірних олій і обумовлює приємний запах квітів, плодів і ягід. Естери трьохатомного спирту гліцерину та вищих жирних кислот є основою жирів, а вищих одноатомних спиртів і монокарбонових жирних кислот — воску та спермацету (жироподібна маса, яку продукують у великій кількості кашалоти).
7. Фізичні властивості. Естери нижчих карбонових кислот і спиртів — безбарвні леткі рідини з приємним фруктовим запахом. Оцтово-ізоаміловий естер має запах груші, масляно-бутиловий — ананасу. Естери мінеральних кислот — маслянисті рідини з приємним запахом, вищих спиртів і вищих карбонових кислот — тверді речовини, що майже не мають запаху. Вони мало розчинні у воді й добре — в спирті та інших органічних розчинниках. Температури плавлення та кипіння естерів нижчих спиртів менші, ніж у відповідних кислот.
Хімічні властивості. Найважливішою хімічною властивістю естерів є їх взаємодія з водою — гідроліз або омилення. Якщо естер, наприклад етилетаноат, нагрівати з водою за наявності неорганічної кислоти (або лугу), утворюються оцтова кислота (чи її сіль) та етиловий спирт:
![]()
Гідроліз естерів — процес, протилежний реакції етерифікації
9. Одержання. Природні естери екстрагують з рослин органічними розчинниками. Промисловий спосіб їх одержання базується на реакції естерифікації.
https://youtu.be/P4JYvhDz5U4
10. Застосування. Естери застосовують:
Ø як розчинники та розріджувачі для лаків і фарб
Ø як ароматизатори в харчовій промисловості
Ø у виробництві парфумів
Ø при виготовленні штучних волокон (лавсан)
Ø для виробництва СМЗ та вибухових речовин
· як розчинники у харчовій промисловості (для приготування фруктових есенцій);
· у косметиці;
· у медицині (ізоамілнітрат, етилнітрат).
Вищі естери становлять основу природних воскоподібних речовин. Розрізняють:
• бджолиний — виробляється спеціальними залозами медоносних бджіл, з якого вони будують сота;
• вовняний (ланолін) — виділяється залозами шкіри тварин, оберігає вовну і шкіру тварин від вологи, висихання і забруднення;
• спермацет — вміст «спермацетового» мішка у голові кашалотів, на який припадає до 90 % маси голови, найімовірніше бере участь в ехолокації, а також має низку інших функцій (зокрема пірнання);
• рослинні воски вкривають тонким шаром листя, стебла ,плоди, оберігаючи їх від висихання, шкідників.
https://tydyvy.com/video/Dyk7EwI
Домашнє завдання: перегляньте відео, матеріали підручника п.21
Навчальний проект: Етери та естери в косметиці.
04.02.2022.
https://meet.google.com/yyy-szea-agg - запрошую на відеозустріч о 13-00
Тема: Вивчення будови, властивостей, застосування етанової кислоти
Склад і будова молекули етанової кислоти. На прикладі етанової (оцтової) кислоти ви ознайомитеся з представником класу оксигено-вмісних органічних сполук — кислотами.
Розчин цієї кислоти з масовою часткою 9 % відомий під назвою «оцет», його використовують як смакову приправу.
Розглянемо склад і будову молекули етанової кислоти. Її можна розглядати як похідну метану, у молекулі якого один атом Гідрогену заміщений на групу —СООН.

Фізичні властивості. Етанова кислота — безбарвна рідина, прозора, з характерним запахом, летка, кисла на смак. Вона добре розчиняється у воді й сама розчиняє чимало органічних сполук.
Густина етанової кислоти за звичайних умов — 1,05 г/см3, тобто вона трохи важча за воду. Температура плавлення становить 16,6 °С, температура кипіння — 181,1 °С.
Поясніть, чому температура кипіння етанової кислоти є високою.
Хімічні властивості. З’ясуємо склад молекули етанової кислоти. Вона складається з групи —CH3 та карбоксильної групи. Атом Оксигену, сполучений подвійним зв’язком з атомом Карбону, як більш електронегативний, спричиняє зміщення електронної густини до нього. У результаті послаблюється зв’язок між атомами Оксигену та Гідрогену. Атом Гідрогену стає рухливіший і може заміщуватися, підтверджуючи її кислотний характер.

Електролітична дисоціація. Зважаючи на те, що етанова кислота є слабким електролітом, вона дисоціює частково на йони — катіони Гідрогену й аніони кислотного залишку:

Результати проведених досліджень свідчать про те, що етанова кислота проявляє властивості, подібні до властивостей неорганічних кислот.
Однак, як органічна сполука, вона горить слабосвітним полум’ям з утворенням карбон(ІУ) оксиду та води.
Застосування етанової кислоти. Етанова кислота, що відома людству здавна, має надзвичайно широкий спектр застосування в побуті та різних галузях промисловості (рис. 100).
Розкажіть про застосування етанової кислоти, користуючись схемою (рис. 100), або виконайте навчальний проект.

Домашнє завдання: перегляньте відео, матеріали підручника п.19
https://www.youtube.com/watch?v=j0rh5rbxmCM
28.01.2022. - 31.01. 2022
Тема:Карбонові кислоти, їх поширення в природі та класифікація.Карбоксильна група, ізомерія, номенклатура.
Одержання етанової кислоти.
Карбонові кислоти, на відміну від альдегідів, дуже поширені в природі органічні сполуки. Вони входять до складу рослинних і тваринних організмів. Мурашина, лимонна, щавлева, янтарна, яблучна кислоти є у вільному стані, водночас залишки їхніх молекул містять у своєму складі жири, естери й інші сполуки. До таких кислот належать етанова (оцтова), бутанова (масляна), гексадеканова (пальмітинова), октадеканова (стеаринова) та ін.
Класифікують карбонові кислоти за кількістю в їхньому складі характеристичних (функціональних) груп атомів -СООН. Якщо кислота містить у своєму складі одну характеристичну (функціональну) групу, її називають одноосновною, дві — двоосновною, більше — багатоосновною.
Залежно від природи вуглеводневого ланцюга розрізняють гомологічні ряди кислот: насичені одноосновні карбонові кислоти та ненасичені: алкенові, алкінові, ароматичні (рис. 32).
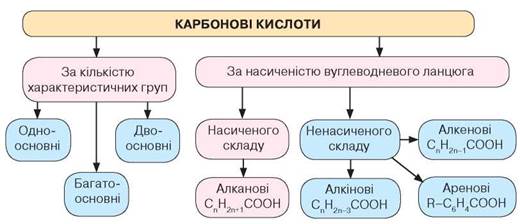
Схема класифікації карбонових кислот
Склад і будова молекул насичених одноосновних кислот. Ознайомившись зі схемою класифікації кислот, можна зробити висновок: до насичених одноосновних карбонових кислот належать такі, що у своєму складі містять одну характеристичну (функціональну) карбоксильну групу -СООН і насичений вуглеводневий ланцюг. Їхню будову розглядають як похідні алканів, у молекулах яких один атом Гідрогену заміщений на карбоксильну групу
Насичені одноосновні карбонові кислоти утворюють гомологічний ряд, вісім представників якого наведено в табл. 10.
Таблиця
Гомологічний ряд одноосновних карбонових кислот та їхні фізичні властивості
Молекулярна формула | Назва кислоти | Температура, °С | Агрегатний стан | ||
систематична | тривіальна | Тпл | Т кіп | ||
Н-СООН | Метанова | Мурашина | 8 | 101 | Рідини з різким запахом, добре розчинні у воді. |
СН3-СООН | Етанова | Оцтова | 17 | 118 | |
С2Н5-СООН | Пропанова | Пропіонова | -21 | 141 | Оліїсті речовини, менш розчинні у воді, з неприємним запахом. |
С3Н7-СООН | Бутанова | Масляна | -7,9 | 164 | |
С4Н9-СООН | Пентанова | Валеріанова | -35 | 185 | |
С5Н11-СООН | Гексанова | Капронова | -3,4 | 205 | |
Продовження табл.

Номенклатура насичених одноосновних кислот. Утворення назв гомологів за систематичною номенклатурою наведено в таблиці
Одноосновним карбоновим кислотам властива структурна ізомерія карбонового ланцюга. Напишемо структурні формули пентанової кислоти та її ізомерів:

Хімічні властивості етанової кислоти. На хімічні властивості етанової кислоти впливає будова її характеристичної (функціональної) групи.
Вам уже відомо, що характеристична група молекули етанової кислоти складається з двох груп: гідроксильної -ОН і карбонільної >С=О. Атом Оксигену, що міститься в складі карбонільної групи, відтягує на себе електронну густину хімічного зв'язку, унаслідок чого зв'язок між атомами Оксигену й Гідрогену в гідроксильній групі послаблюється. Зміщення електронної густини, яке можна зобразити так:
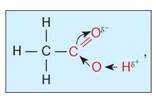
визначає кислотні властивості цієї речовини.
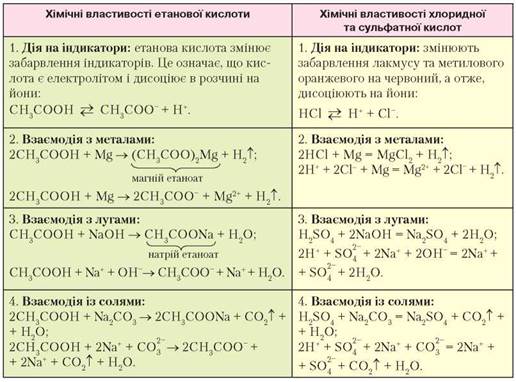
Для того щоб переконатися, що різкої межі між неорганічними та органічними речовинами немає, звернемося до таблиці і порівняємо хімічні властивості насичених одноосновних карбонових кислот (на прикладі етанової) і неорганічних (хлоридної, сульфатної) кислот.
Порівняльна характеристика хімічних властивостей етанової та неорганічних кислот
Добування етанової кислоти. Вам уже відомо, що внаслідок часткового окиснення альдегідів утворюються карбонові кислоти
Пригадайте реакції часткового окиснення альдегідів. Напишіть рівняння реакцій.
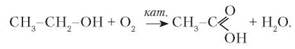
Окиснення етанолу. Етанову кислоту добувають окисненням етанолу за наявності каталізатора. Рівняння реакції:
Окиснення етаналю. Оскільки з реакцією часткового окиснення етаналю ви вже ознайомилися , то зазначимо, що окисниками можуть бути й калій перманганат, калій дихромат та інші сильні окисники. Рівняння реакції:
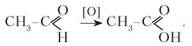
Економічно вигідний промисловий спосіб добування етанової кислоти — це окиснення алканів повітрям за наявності каталізаторів.
ПІДСУМОВУЄМО ВИВЧЕНЕ
• Карбонові кислоти класифікують за кількістю характеристичних (функціональних) груп і за насиченістю вуглеводневого ланцюга.
• До насичених одноосновних карбонових кислот належать такі, що містять у своєму складі одну характеристичну (функціональну) карбоксильну групу й насичений вуглеводневий ланцюг.
• Будову насичених одноосновних карбонових кислот розглядають як похідні алканів, у молекулах яких один атом Гідрогену заміщений на карбоксильну групу -СООН. Загальна формула CnH2n+1COOH або R-COOH.
• Назви насичених одноосновних карбонових кислот утворюють за алгоритмом: алкан + ова + кислота. Наприклад: етан + ова + кислота → етанова кислота.
• Наявність карбоксильної групи в складі молекули карбонових кислот визначає їхні фізичні й хімічні властивості.
• Хімічні властивості карбонових кислот подібні до властивостей неорганічних кислот, крім взаємодії зі спиртами, унаслідок якої утворюються естери карбонових кислот.
• Реакції між карбоновими кислотами та спиртами з утворенням естерів називають реакціями естерифікації.
• Добувають насичені одноосновні карбонові кислоти окисненням спиртів (за наявності каталізатора) та альдегідів.
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ: п. 18
- 1. Поясніть, за якими ознаками класифікують карбонові кислоти.
- 2. Охарактеризуйте склад і будову насичених одноосновних карбонових кислот.
- 3. Дайте назви структурним ізомерам насичених одноосновних карбонових кислот за систематичною номенклатурою:


- 4. Порівняйте хімічні властивості сульфатної та етанової кислот, використовуючи конкретні приклади.
- 5. Складіть структурні формули кислот за їхніми назвами: а) 2,2-диметилбутанова кислота; б) 2-метил-3-хлоропентанова кислота; в) 2-етил-3-метилпентанова кислота.
- 6. Складіть рівняння реакцій між речовинами:
а) С2Н5-СООН + Mg → ... ;
б) С3Н7-СООН + KOH → ... ;
в) С2Н5-СООН + K2CO3 → ... ;
г) СН3-СООН + OH-C2H5 → ... ;
ґ) СН3-СНО + Ag2O → ... ;
д) СН3-СНО + Cu(OH)2 → ... ;
е) СН3-СН2-ОН + О2 → ... ;
є) С3Н7-СНО + О2 → ... .
- 7. Дано речовини: етанол, натрій гідроксид, калій карбонат, кальцій оксид, купрум(ІІ) гідроксид, водень. Установіть, з якими з них реагуватимуть етанова й сульфатна кислоти. Напишіть молекулярні та, де можливо, йонні рівняння хімічних реакцій.
- 8. Складіть рівняння хімічних реакцій за схемою. Назвіть речовини, позначені літерами А, Б і В.

05.11.2021.
Тема: Ненасичені вуглеводні. Арени. Бензен.
1. Ознайомтесь
Бензен. Найпростішим ароматичним вуглеводнем є бензен С6Н6 (тривіальна назва — бензол). Цю сполуку відкрив у 1825 р. англійський учений М. Фарадей; вона у вигляді рідини накопичувалася в ємностях зі світильним газом, який використовували у вуличних ліхтарях.
Будова молекули. Властивості бензену, виявлені хіміками, не давали змоги однозначно описати будову його молекули. Атомів Гідрогену в молекулі бензену С6Н6значно менше, ніж у молекулі насиченого вуглеводню гексану С6Н14. Це вказувало на наявність у молекулі бензену подвійних або навіть потрійних зв’язків (тобто бензен мав бути ненасиченим вуглеводнем). Однак сполука виявилася хімічно пасивною (як і насичені вуглеводні), на відміну від алкенів і алкінів не знебарвлювала бромної води, розчину калій перманганату. Щоправда, за особливих умов молекула С6Н6 усе ж приєднувала три молекули водню або хлору.

Фрідріх-Август Кекуле (1829—1896)
Видатний німецький хімік, президент Німецького хімічного товариства, професор Гентського та Боннського університетів, іноземний член-кореспондент Петербурзької академії наук. Зробив вагомий внесок у теорію будови органічних сполук і вчення про валентність. Спрогнозував чотиривалентність Карбону і сполучення атомів Карбону в ланцюги. Запропонував циклічну формулу молекули бензену. Вперше синтезував низку органічних сполук. Автор підручника з органічної хімії, в якому визначив цю галузь науки як хімію сполук Карбону. Один з організаторів І Міжнародного конгресу хіміків. Заснував наукову школу. Серед учнів Кекуле — хіміки Л. Мейєр, нобелівські лауреати А. Байєр, Я. Вант-Гофф, Е. Фішер.
Також було з’ясовано, що похідні бензену з одним атомом галогену в молекулах не мали ізомерів (у разі відкритого карбонового ланцюга існування ізомерів є очевидним). Це свідчило про рівноцінність розміщення атомів Карбону в молекулі С6Н6, що можливо лише при їх сполученні в замкнений ланцюг.
Ураховуючи сукупність виявлених фактів, учені запропонували кілька структурних формул молекули бензену. Із більшістю фактів найкраще узгоджувалася формула німецького хіміка Ф.-А. Кекуле (1865 р.):

Однак і вона не пояснювала, чому бензен, маючи кратні зв’язки, за звичайних умов не вступав у реакції приєднання.
Пізніше Ф.-А. Кекуле припустив, що подвійні зв’язки не закріплені в молекулі С6Н6, а постійно переміщуються від одного атома Карбону до іншого.
Результати подальших досліджень підтвердили рівноцінність атомів Карбону в молекулі бензену, а також їх розміщення в одній площині, в кутах правильного шестикутника (мал. 15).

Мал. 15. Моделі молекули бензену: а — кулестержнева; б — масштабна
Згідно із сучасними уявленнями, між атомами Карбону в молекулі бензену немає звичайних простих і подвійних зв’язків. Орбіталі одного 2s-електрона і двох 2p-електронів кожного атома Карбону при утворенні хімічних зв’язків змінюють форму на однакову й розміщуються під кутами 120°. Вони перекриваються з відповідними орбіталями сусідніх атомів Карбону й атома Гідрогену (мал. 16, а).

Мал. 16. Перекривання змінених за формою орбіталей (а) і р-орбіталей (б) атомів Карбону в молекулі бензену


Мал. 17. Замкнена електронна система в молекулі бензену, утворена р-електронами
Отже, в молекулі бензену існує замкнена електронна система, утворена p-електронами1. Тому структурну формулу молекули С6Н6 часто зображують так:

Молекула бензену завдяки своїй симетричності неполярна.
1 Так звана π-електронна система.
Фізичні властивості. Бензен — безбарвна летка рідина зі своєрідним запахом, легша за воду (густина 0,88 г/см3). Температура плавлення бензену +5,5 °С, кипіння +80,1 °С. Сполука погано розчиняється у воді, але добре — в органічних розчинниках. Цей вуглеводень розчиняє йод (мал. 18), сірку, білий фосфор, жири, інші органічні речовини.

Мал. 18. Розчинення йоду в бензені
Бензен — одна з найстійкіших органічних сполук; його пара не розкладається до 600 °С.
Хімічні властивості. Бензен хоч і є подібним до ненасичених вуглеводнів, проте виявляє достатню хімічну пасивність. Характерними для сполуки є реакції заміщення, під час яких зберігається електронна система бензенового кільця. Реакції приєднання й окиснення за участю бензену призводять до руйнування цієї системи; вони відбуваються за високої температури, дії ультрафіолетового випромінювання, наявності каталізаторів.Реакції заміщення. Атоми Гідрогену в молекулі бензену можуть заміщуватись на атоми галогенів. Із хлором і бромом сполука взаємодіє за наявності каталізаторів1. Найлегше відбувається перша стадія — заміщення одного атома Гідрогену в молекулі бензену:

1 З йодом бензен реагує за особливих умов.
Реакції приєднання. Бензен, як і ненасичені вуглеводні, може вступати в реакції приєднання. Вони відбуваються за жорстких умов:


Реакція окиснення. Бензен, як і інші вуглеводні, є горючою речовиною. Під час горіння сполуки на повітрі, крім вуглекислого газу і води, утворюється невелика кількість вуглецю. Його часточки розжарюються в полум’ї (воно стає яскравим), а потім згоряють. Горіння бензену супроводжується появою кіптяви (мал. 19).

Мал. 19. Горіння бензену
Напишіть рівняння реакції горіння бензену в надлишку кисню.
Через особливу стійкість молекули бензен інертний щодо речовин-окисників. Зокрема, він не взаємодіє з калій перманганатом. Цим бензен відрізняється від алкенів і алкінів.
Арени. Крім бензену, відомо багато вуглеводнів із подібною замкненою електронною системою в молекулах, утвореною р-електронами.Вуглеводні, у молекулах яких є одне чи кілька бензенових кілець, називають аренами, або ароматичними вуглеводнями.
Бензен С6Н6 є першою сполукою в гомологічному ряду аренів з одним бензеновим кільцем у молекулі.
Існують арени з кількома бензеновими кільцями в молекулах. Структурні формули молекул найважливіших аренів цього типу:

2.ВИСНОВКИ
Бензен С6Н6 — найпростіший ароматичний вуглеводень.
У молекулі бензену всі атоми Карбону розміщені в одній площині у вершинах правильного шестикутника. Замкнена електронна система в молекулі бензену, утворена р-електронами, зумовлює хімічну стійкість сполуки.
Бензен — безбарвна летка рідина зі своєрідним запахом, легша за воду, добре розчиняється в органічних розчинниках. Сполука вступає в реакції заміщення, приєднання й окиснення.
Вуглеводні з одним або кількома бензеновими кільцями в молекулах називають аренами, або ароматичними вуглеводнями.
3.Домашнє завдання: опрацювати п.11, виконати завдання № 77,78 ст.67
01.11.2021.
Тема: Алкени та алкіни. Загальна та молекулярні формули. Структурна ізомерія, систематична номенклатура. Хімічні властивості етену та етину.
https://meet.google.com/evx-kbyq-bwn - відеозустріч
АЛКЕНИ ТА АЛКІНИ
Вивчивши матеріал, ви зможете:
- називати алкени, алкіни та їхні ізомери за систематичною номенклатурою; загальні формули алкенів та алкінів;
- наводити приклади сполук, що мають ненасичений склад молекул; структурних формул ізомерів етену й етину;
- розпізнавати структурні ізомери етену й етину;
- складати молекулярні та структурні формули алкенів та алкінів на основі їхніх загальних формул; формули ізомерів алкенів та алкінів за молекулярною формулою сполуки; рівняння реакцій, що описують хімічні властивості етену й етину;
- характеризувати хімічні властивості алкенів та алкінів; способи їх добування;
- установлювати взаємозв'язки між складом, хімічною будовою та властивостями речовин;
- обґрунтовувати застосування алкенів та алкінів.
Молекулярні та загальні формули алкенів й алкінів. Ненасичені вуглеводні, так само як і метанові (насичені), здатні утворювати гомологічні ряди, де кожний наступний член ряду відрізняється від попереднього на групу атомів -CH2-.
Пригадайте, як називають групу атомів -СН2-.
Ознайомимося з табл. де наведено назви, молекулярні та напівструктурні формули гомологів етену й етину, і порівняємо склад їхніх молекул.
Порівняльна характеристика складу молекул етенових та етинових вуглеводнів
Етенові вуглеводні | Етинові вуглеводні | ||||
Назва | Формули | Назва | Формули | ||
молекулярна | напівструктурна | молекулярна | напівструктурна | ||
Етен | C2H4 | CH2=CH2 | Етин | C2H2 | CH≡CH |
Пропен | C3H6 | CH2=CH-CH3 | Пропін | C3H4 | CH≡C-CH3 |
Бутен | C4H8 | CH2=CH-CH2-CH3 | Бутин | C4H6 | CH≡C-CH2-CH3 |
Назви етенових вуглеводнів походять від назв алканів із заміною суфікса -ан на -ен. | Назви етинових вуглеводнів походять від назв алканів із заміною суфікса -ан на -ин або -ін. | ||||
Загальна формула СnН2n. | Загальна формула СnН2n-2. | ||||
• Вуглеводні із загальною формулою СnН2n, у молекулах яких між атомами Карбону є один подвійний зв'язок, називають алкенами.
• Вуглеводні із загальною формулою СnН2n-2, у молекулах яких між атомами Карбону наявний один потрійний зв'язок, називають алкінами.
Cтруктурна ізомерія алкенів та алкінів. Алкенам й алкінам властива структурна ізомерія карбонового ланцюга та ізомерія за положенням кратного (подвійного або потрійного) зв'язку.
Розглянемо ці види ізомерії на прикладі пентену та пентину

Структурна ізомерія алкенів та алкінів
Алгоритм утворення назв структурних ізомерів. Проаналізувавши рис. 17, ви вже, мабуть, зрозуміли, як складають формули структурних ізомерів ненасичених вуглеводнів. Визначимо послідовність дій:
1) вибираємо за головний найдовший карбоновий ланцюг і нумеруємо атоми Карбону з того кінця, до якого ближче кратний зв'язок;
2) указуємо атом Карбону, біля якого є алкільний замісник, і його назву;
3) називаємо вуглеводень з найдовшим ланцюгом, локант, що вказує на положення кратного зв'язку, і суфікс, властивий цим вуглеводням.
Хімічні властивості етену й етину. Оскільки етен та етин є ненасиченими сполуками, вони мають подібні хімічні властивості. Щоб переконатися в цьому, ознайомимося
Таблиця
Порівняльна характеристика хімічних властивостей етену та етину

Реакцію взаємодії етину з водою відкрив російський хімік-органік М. Кучеров у 1881 р. Вона дістала назву «реакція Кучерова» й відіграла важливу роль у розвитку хімії органічного синтезу.
Пригадайте інші хімічні властивості етену й етину як ненасичених вуглеводнів. Складіть відповідні рівняння реакцій.
Способи добування. Етен добувають під час промислової переробки нафти. За основу способу переробки взято реакцію
![]()
Етен можна добути з етану реакцією дегідрування (відщеплення водню):
СН3-СН3 → СН2=СН2 + Н2.
Реакція відбувається за нагрівання та наявності каталізатора.
Етин добувають з кальцій карбіду під час взаємодії його з водою:

З реакцією розкладу метану за високих температур ви вже ознайомилися вивчаючи властивості алканів.
Взаємозв'язки між вуглеводнями. Вивчаючи хімічні властивості алканів, алкенів, алкінів і способи їх добування, ви переконалися, що між вуглеводнями існують тісні взаємозв'язки. За певних умов алкани, вступаючи в реакції дегідрування, перетворюються на алкени чи алкіни. Унаслідок взаємодії алкенів та алкінів з воднем (гідрування) утворюються алкани. Під час реакцій галогенування або приєднання гідроген галогенідів отримують галогенопохідні вуглеводнів.
Взаємозв'язки між цими речовинами простежуються на прикладі ланцюжків перетворень:
CH4 → C2H2 → C2H4 → C2H5Cl; CaC2 → C2H2 → C2H4 → C2H4Cl2.
Складіть самостійно рівняння реакцій за наведеними схемами.
ПІДСУМОВУЄМО ВИВЧЕНЕ
• Алкени та алкіни — ненасичені вуглеводні, які, так само як і насичені, утворюють відповідні гомологічні ряди.
• За систематичною номенклатурою назви алкенів утворюють від назв відповідних алканів заміною суфікса -ан на суфікс -ен, а назви алкінів — заміною суфікса -ан на суфікс -ин або -ін.
• Назву структурних ізомерів складають у такій послідовності: 1) вибирають найдовший карбоновий ланцюг і нумерують атоми Карбону з того кінця, до якого кратний зв'язок розміщений ближче; 2) указують атом Карбону, біля якого є алкільний замісник, і його назву; 3) називають вуглеводень із найдовшим ланцюгом, локант, що вказує на положення кратного зв'язку, і суфікс, властивий цим вуглеводням.
• Алкени та алкіни проявляють подібні хімічні властивості, що пояснюється наявністю кратних зв'язків. Зокрема, вони вступають у реакції повного й часткового окиснення, приєднання галогенів і гідроген галогенідів, гідрування й гідратації.
• Загальна формула алкенів CnH2n, алкінів CnH2n-2.
• Між насиченими й ненасиченими вуглеводнями існують тісні взаємозв'язки.
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
- 1. Сформулюйте визначення понять «алкени», «алкіни».
- 2. Назвіть структурні ізомери вуглеводнів за їхніми формулами:

- 3. Складіть напівструктурні формули сполук за їхніми назвами:
а) 3,3-диметилпент-1-ен;
в) 3-метилпент-1-ин;
ґ) 4-метилпент-2-ин;
е) пент-2-ин;
б) 4-етил-3,4-диметилгепт-2-ен;
г) 3-етилгекс-1-ин;
д) 3,3,4,4-тетраметилгекс-1-ен;
є) 2,2-диметилгепт-3-ин.
- 4. Напишіть рівняння реакцій між речовинами, назвіть продукти реакцій:
а) СН2=СН2 + Br2 → ... ;
б) СН≡СН + Cl2 → ... ;
в) СН2=СН2 + НBr → ... ;
г) CH2=CH2 + O2 → ... ;
ґ) СН2=СН2 + KMnO4 → ... ;
д) CH2=CH2 + HCl → ... ;
е) СН≡СН + Н2О → ... ;
є) CH≡CH + 2H2 → ... .
- 5. Класифікуйте речовини, подані формулами, на алкани, алкени й алкіни: С5Н10, С2Н6, С3Н4, С9Н20, С4Н6, С6Н14, С7Н14, С8Н16, С5Н8, С2Н2, С8Н18.
- 6. Складіть рівняння хімічних реакцій за схемою. Назвіть речовини, зазначені літерами А і Б.

- 7. Етан масою 240 г дегідрували. Обчисліть масу етену та об'єм водню (н. у.), що утворилися.
- 8. Речовина містить атоми Карбону, масова частка яких становить 88,89 %, решта Гідроген. Відносна густина речовини за аргоном дорівнює 1,35. Виведіть її молекулярну формулу. Назвіть речовину, складіть напівструктурну формулу.
Немає коментарів:
Дописати коментар