Хімія 11- А клас

- метал + неметал = сіль. Наприклад: у реакціях натрію з хлором утворюється натрій хлорид:
2Na+Cl2=2NaCl . - Основний оксид + кислотний оксид = сіль. Наприклад: при взаємодії кальцій оксиду з карбон (IV) оксидом утворюється кальцій карбонат:
CaO+CO2=CaCO3 . - Основний оксид + кислота = сіль + вода. Наприклад: у результаті взаємодії купрум(II) оксиду і сульфатної кислоти утворюється купрум (II) сульфат:
CuO+H2SO4=CuSO4+H2O . - Основа (луг) + кислотний оксид = сіль + вода. Наприклад: при взаємодії калій гідроксиду з фосфор(V) оксидом утворюється сіль калій ортофосфат:
6KOH+P2O5=2K3PO4+3H2O . - Основа + кислота = сіль + вода. Наприклад: у результаті реакції взаємодії ферум(II) гідроксиду з нітратною кислотою утворюється ферум (II) нітрат:
Fe(OH)2+2HNO3=Fe(NO3)2+2H2O
https://www.youtube.com/watch?v=tIqfNnfrQlo
Перегляньте відеоматеріали.
Д.З. Повторити п. 30 - 32,скласти опорний конспект; п. 33 (підготуватись до практичної роботи №1 ст 178)
Хімія. Рівень стандарту. 11 клас. Ярошенко
Хімія — це життя: сторінка природодослідника
Практична робота 1. Дослідження якісного складу солей
1. Експериментальним шляхом доведіть вміст у пробірці розчину:
-
2. Проведіть досліди, за допомогою яких можна встановити:
-
3. Експериментальним шляхом установіть:
-
Результати спостережень, зроблені на основі відео, висновки, молекулярні та йонні рівняння проведених реакцій запишіть у зошит для практичних робіт.
Д.З. на основі матеріалів підручника, відеоматеріалів виконати практичну роботу №1, підручник п.33 ст.178
Виробництво мінеральних добрив. Для підвищення врожайності сільськогосподарських культур використовують мінеральні добрива — речовини, які містять найважливіші хімічні елементи, що впливають на ріст і розвиток рослин, збільшуючи їхню врожайність.
Передусім — це солі, що містять макро- й мікроелементи, які рослини поглинають у формі йонів. Вони утворюються внаслідок дисоціації солей, що містяться в ґрунтовому розчині. Рослини у великих кількостях використовують макроелементи, особливо Нітроген, Фосфор і Калій. Крім них, до макроелементів належать Оксиген, Карбон, Сульфур, Магній, Кальцій та Гідроген.
З'ясуємо, як Нітроген, Фосфор і Калій впливають на рослини.
Нітроген — елемент, що входить до складу молекул амінокислот і білків. Нестача його в ґрунті сповільнює утворення зеленої маси, що, відповідно, впливає на майбутній урожай. Вам відомо, що зелена маса рослин розвивається навесні. Якраз тоді потрібно вносити в ґрунт нітратні добрива — добрива, що містять Нітроген). Рослини, яким бракує Нітрогену, мають блідо-зелені, а іноді й жовті листки.
Фосфор — елемент, потрібний для росту та розвитку рослин, оскільки він є в нуклеїнових кислотах, а ті беруть участь в усіх окисно-відновних процесах рослин. Потрібний також під час цвітіння та плодоношення рослин, тобто для розвитку їхніх репродуктивних органів.
Калій — елемент, що стимулює процес фотосинтезу, а отже, сприяє утворенню глюкози, крохмалю, целюлози в клітинах рослин. Під час негоди злакові культури вилягають, що ускладнює їхній ріст і збір урожаю. Цей елемент зміцнює стебла злакових, сприяє накопиченню крохмалю в картоплі, сахарози в цукровому буряку.
Мікроелементи — елементи, яких рослини потребують мало, але вони впливають на засвоєння макроелементів. До них належать Ферум, Купрум, Цинк, Манган, Бор та ін. Наприклад, Бор і Манган сприяють кращому засвоєнню Нітрогену, Фосфору та Калію; Манган, Купрум і Цинк пришвидшують окисно-відновні процеси тощо.
Класифікацію мінеральних добрив зображено на схемі рис.

Рис. Схема класифікації мінеральних добрив
Кислотні та лужні ґрунти. На розвиток коріння та ріст рослин значною мірою впливає реакція середовища ґрунту, або його рН. Найчастіше рН ґрунтів вимірюють у діапазоні від 3 до 9. Залежно від цього показника, середовище ґрунтових розчинів може бути кислотним, нейтральним або лужним.
Кислотність ґрунту визначають надмірним вмістом у ґрунтовому розчині катіонів Гідрогену Н+, pH становить менше 7. У кислотних ґрунтах розрізняють актуальну та потенційну кислотність. Під час біохімічних процесів у ґрунті утворюються органічні кислоти й вуглекислий газ, а внаслідок його взаємодії з водою — карбонатна кислота. Наявні кислоти, дисоціюючи, утворюють йони Гідрогену, які підкислюють ґрунт. Під час гідролізу солей Алюмінію та Феруму теж утворюються кислоти, здатні дисоціювати на катіони Гідрогену.
Складіть самостійно рівняння реакції гідролізу алюміній хлориду й переконайтеся в утворенні хлоридної кислоти.
Висока кислотність ґрунту негативно впливає на рослини. Щоб її нейтралізувати, застосовують вапнування ґрунту — внесення вапняку, вапняного борошна, крейди, мергелю або гашеного вапна. Нині також поширені способи використання відходів. Зокрема, для зниження кислотності ґрунту використовують відходи виробництва цукру, які містять кальцій карбонат і попіл.
Для лужних ґрунтів характерною є надмірна кількість гідроксид-аніонів у ґрунтовому розчині, рН такого ґрунту становить 7,5-8,5. Дуже лужні ґрунти вкрай погано впливають на врожайність. Крім того, погіршуються його фізичні властивості та водний режим. Зменшення вмісту гідроксид-іонів досягають гіпсуванням, тобто внесенням у ґрунт гіпсу. Під час взаємодії кальцій сульфату з катіонами Натрію утворюється натрій сульфат — сіль, яка добре розчинна у воді та легко вимивається з ґрунту.
Найкраще середовище для розвитку рослин — нейтральне, коли рН вимірюється в межах 5,5-7,5.
Щоб підтримувати високу врожайність сільськогосподарської продукції, необхідно стежити за кислотністю ґрунтів на присадибній ділянці.
Пригадайте з курсу хімії 9 класу, як виміряти рН продуктів харчування та мінеральних вод.
Звичайно, для цього можна використати лакмусовий індикатор і зіставити його зі шкалою кислотності, що продається у формі кольорових рН-смужок. Однак такий спосіб визначення кислотності складний та не завжди точний. Він вимагає виготовлення ґрунтового розчину, незіпсованого індикатора та сприйняття кольору людиною.
Є біологічний спосіб визначення кислотності за допомогою рослин-індикаторів (рис. ). Наприклад, на кислотних ґрунтах добре ростуть подорожник, хвощ польовий, калюжниця болотна, яглиця, щавель кінський; на нейтральних — пирій повзучий, конюшина, кропива, осот польовий, мати-й-мачуха; лужні ґрунти покриваються червоними маками, гірчицею, живокостом, молочаєм тощо. Знову ж таки, чекаючи, коли зацвітуть на ділянці ці рослини-бур'яни, можна втратити частину врожаю.

Рис. Рослини-індикатори кислотності ґрунту: а — подорожник; б — хвощ польовий; в — калюжниця; г — щавель кінський; ґ — кропива; д — конюшина; е — мати-й-мачуха; є — осот польовий; и — мак; і — живокіст; ї — молочай
Нині є надійні засоби для вимірювання кислотності як у лабораторіях, так і для домашнього користування. Це рН-тестери, за допомогою яких швидко та професійно можна визначити кислотність ґрунту на присадибній ділянці чи грядці, штучно створеній на підвіконні.
Д.З. :Опрацюйте матеріал підручника, сайту, відео.
• Складні речовини із загальною формулою

належать до класу солей.
• Солі — це електроліти, що дисоціюють з утворенням катіонів металічного елемента й аніонів кислотного залишку, наприклад: К2СО3 = 2К+ + СО2-3.
• Усі солі мають твердий агрегатний стан, багато з них добре розчинні у воді, зокрема всі нітрати, усі солі Калію й Натрію.
• Кристалогідрати — солі, які містять кристалізаційну воду, наприклад мідний купорос, залізний купорос.
• Серед неорганічних сполук за поширеністю у природі солі займають друге місце після оксидів.
СЕРЕДНІ СОЛІ. Дотепер ви мали справу переважно з середніми солями. Так називають продукти повного заміщення Гідрогену в молекулі кислоти йонами металічного елемента, наприклад: K2SO4, K3PO4.
Середні солі — продукти повного заміщення атомів Гідрогену йонами металічного елемента в молекулі кислоти. Їхні кислотні залишки не містять атомів Гідрогену:
![]()
Як ви знаєте, за сучасною номенклатурою назви середніх солей утворюють з двох слів у називному відмінку: першим називають катіон металічного елемента, другим — аніон кислотного залишку, який є однокорінним із назвою відповідної кислоти, наприклад: СаСl2 — кальцій хлорид (хлоридна кислота), Na3PO4 — натрій ортофосфат (ортофосфатна кислота), KNO3 — калій нітрат (нітратна кислота). Відмінюється тільки друге слово, наприклад: кальцій хлоридом, калій нітрату.
КИСЛІ СОЛІ. Якщо катіони Гідрогену в кислоті неповністю заміщені катіонами металічного елемента, утворюються кислі солі.
Кислі солі — продукт неповного заміщення Гідрогену в кислоті катіонами металічного елемента, тому кислотні залишки таких солей містять Гідроген, наприклад KHSO4, KН2РО4, K2НРО4.
Назви кислотних залишків кислих солей складають так, щоб у них було відображено наявність Гідрогену. Так, кислотний залишок HSO-4 одновалентний і має назву гідрогенсульфат, а сіль KНSO4 — калій гідрогенсульфат. А яка валентність кислотного залишку калій гідрогенортофосфату К2НРО4? Міркуємо так: у молекулі ортофосфатної кислоти Н3РО4 відбулося заміщення двох атомів Гідрогену. Отже, залишок двовалентний. Саме тому у формулі після символу одновалентного Калію стоїть індекс 2.
Наявність двох атомів Гідрогену в назві кислої солі передають приставкою «дигідроген», наприклад: KН2РО4 — калій дигідрогенортофосфат.
ХІМІЧНІ ВЛАСТИВОСТІ КИСЛИХ СОЛЕЙ. Кислі солі багато в чому повторюють хімічні властивості середніх солей, хоча мають певні особливості. Зупинимось на них.
1. Електролітична дисоціація
Кислі солі, утворені сильними кислотами, дисоціюють повністю і в одну стадію:
NaHSO4 = Na+ + Н+ + SO2-4.
Кислі солі, утворені слабкими кислотами, дисоціюють у дві стадії.
На першій — повністю:
NaHCO3 = Na+ + НСО-3,
на другій — частково й дисоціація є оборотною реакцією:
НСО-3 ⇄ Н+ + СО2-3.
2. Кислі солі більш сильної кислоти взаємодіють з кислими солями слабкіших кислот, утворюючи слабкішу кислоту й середню чи кислу сіль сильної кислоти:
![]()
ХІМІЧНІ ВЛАСТИВОСТІ СЕРЕДНІХ СОЛЕЙ. Поєднання у складі солей катіонів металічних елементів й аніонів кислотних залишків обумовлює їхні хімічні властивості. Розглянемо хімічні властивості середніх солей.
Попрацюйте групами
Завдання 1. Попрацюйте зі схемою задля відновлення знань про хімічні властивості солей та уміння складати відповідні рівняння реакцій.

ПОШИРЕННЯ СОЛЕЙ У ПРИРОДІ, ЗАСТОСУВАННЯ. Найбільше поширення у природі мають сульфати, карбонати, хлориди.
Природні сульфати — це гіпс CaSO4 · 2Н2О; глауберова сіль Na2SO4 · 10H2О; гірка сіль MgSO4 · 7H2О. Із наведених формул стає зрозуміло, що вони належать до кристалогідратів. Нагріванням гіпсу зменшують вміст у ньому кристалізаційної води й одержують алебастр 2СаSO4 · Н2О. Саме з алебастру накладають пов'язки при переломах кісток. Глауберову сіль Na2SO4 · 10H2О застосовують у виробництві скла, соди, фарб, у медицині. Гірку сіль MgSO4 · 7H2О використовують в обробці тканин, дубінні шкіри, виготовленні медичних препаратів.
КАРБОНАТИ В ПРИРОДІ. Карбонати існують у природі переважно у вигляді кальцій карбонату СаСО3. Крейда, мармур, вапняки, ракушняк — усе це кальцій карбонат з певним умістом некарбонатних домішок. Чистий кальцій карбонат трапляється в природі у вигляді мінералу кальциту. Ісландський шпат (кальцій карбонат високої чистоти) застосовують в оптиці.
 Використання солей
Використання солей
ПОНЯТТЯ ПРО ЖОРСТКІСТЬ ВОДИ. З наявністю у воді солей Кальцію і Магнію — гідрогенкарбонатів, хлоридів та сульфатів — пов'язане поняття жорсткість води.
Жорсткість води — сукупність властивостей води, зумовлена наявністю катіонів Са2+ і Mg2+. Ці йони входять до складу солей хлоридів, сульфатів, гідрогенкарбонатів.
Вода, 1 л якої містить до 2 ммоль/л йонів Са2+ і Mg2+, вважається м'якою. Вода із вмістом йонів Са2+ і Mg2+ понад 10 ммоль/л вважається жорсткою. Прикладом м'якої води є дощова вода, жорсткої — вода морів і океанів.
Домашнє завдання:Опрацюйте матеріал підручника п. 27-28, сайту, відео.
Назва елементу у + (валентність елемента, + слово « гідроксид»
називному відмінку якщо вона змінна)
Наприклад:
Mn(OH)2 -манган(ІІ)
гідроксид
LiOH – літій гідроксид
Mg(OH)2 – магній гідроксид
Fe(OH)3 – ферум(ІІІ) гідроксид
1.
Класифікація основ.
Існує три класифікації
основ. Розгоянемо їх.
В основу першої класифікації покладено кількість
гідроксильних груп, так звана кислотність основ.
Однокислотні Двокислотні Трьохкислотні
NaOH Fe(OH)2 Al(OH)3
Класифікувати
основи можна і за розчинністю у воді.
Розчинні
(луги)
Малорозчинні
Нерозчинні
NaOH Са(OH)2 Fe(OH)3
Назвіть та класифікуйте
запропоновані основи: NaOH, Cu(OH)2, Cr(OH)2, Cr(OH)3, KOH, Ba(OH)2, Fe(OH)2, LiOH за вищевказаними прикладами..
Класифікувати
основи можна за силою електроліту.
Сильні електроліти Слабкі
електроліти
КОН, NaOH,Ba(OH)2 NH3∙H2O
2.
Натрій та Кальцій:
положення в Періодичній системі хімічних елементів та будова атомів.
Оскільки ми вивчаємо гідроксиди Натрію та Кальцію, то почнемо з характеристики цих елементів за положенням у періодичній системі та будовою їх атомів . Адже саме ці фактори обумовлюють властивості елементів і, відповідно, властивості сполук, які вони утворюють.
Натрій та
Кальцій - активні металічні елементи,
сильні відновники, що містяться у головних
підгрупах (А групах) І та ІІ груп періодичної системи. На зовнішньому
енергетичному рівні мають 1 та 2
електрони відповідно, виявляючи типові
для металічних елементів ступені
окиснення +1 та +2. Натрій – типовий
лужний металічний елемент, Кальцій – лужноземельний.
Їх оксиди є основними оксидами, а гідроксиди –
розчинними у воді основами – лугами.
4. Фізичні та хімічні властивості натрію та кальцію.
Фізичні властивості
натрію та кальцію зумовлені металічним зв’язком та металічними кристалічними ґратками.
Натрій та кальцій - м’які, сріблясто – білі метали, з
низькими температурами плавлення, добре проводять електричний струм та тепло.
Відповідно до будови атомів натрій та кальцій - хімічно активні, на повітрі швидко реагують з киснем та водою. Тому їх зберігають у герметично закритому посуді під шаром гасу або у запаяних ампулах.
Реагуючи з водою, ці метали утворюють луги. Якщо
помістити у воду, до якої доданий розчин фенолфталеїну, шматочок лужного або лужноземельного металу,
спостерігається виділення газу та зміна забарвлення індикатора з безбарвного на
малинове.
https://www.youtube.com/watch?v=3vP5gUVdm58 ( відео
«Взаємодія
натрію з водою»)
Про що свідчить зміна забарвлення індикатора?
Складіть рівняння реакцій взаємодії натрію та кальцію з
водою.
Цікавий факт. У давнину лугом називали
милкі розчини попелу, які використовували для прання.
5. Фізичні властивості Натрій та Кальцій
гідроксидів.
Натрій
гідроксид та кальцій гідроксид – мають йонні кристалічні ґратки, які й обумовлюють їх фізичні властивості.
А) Натрій гідроксид
Натрій гідроксид - це біла тверда речовина, що має вигляд
гранул. Вони гігроскопічні та добре розчиняються у воді.
Тривіальні
назви натрій гідроксиду – каустична сода, їдкий натр або їдкий луг (бо ця речовина сильно роз’їдає шкіру). Це пояснюється тим, що при
потраплянні лугів на шкіру відбувається лужний гідроліз ліпідів з утворенням
поверхнево-активних речовин, які руйнують шкіру.
Б) Кальцій гідроксид
Кальцій гідроксид - це біла дрібнокристалічна речовина, яка
також є гігроскопічною та малорозчинною у воді.
Оскільки обидва
гідроксиди гігроскопічні, зберігати їх слід у щільно закритій тарі.
Тривіальна назва кальцій гідроксиду – гашене вапно.
Розчин кальцій гідроксиду називають вапняною водою, а суспензію – вапняним молоком.
Цікавий
факт. Здавна вапняне молоко використовували для штукатурки стін, по яким
художники наносили малюнки, які називаються фрески.
5.
Хімічні властивості
Натрій та Кальцій гідроксидів.
Працюючи з цими речовинами треба пам’ятати, що вони дуже їдкі. При потраплянні їх на
шкіру, слід промити місце опіку великою кількістю холодної води (10-15 хвилин),
а потім обробити розчинами борної кислоти (1 чайна ложка на 200 мл води) або
оцтової кислоти (співвідношення 1:100).
Потім покласти на уражену ділянку шкіру серветку, змочену 5% розчином
оцту, та звернутися до лікаря.
А) Дія лугів на індикатори.
У відео досліді ми вже бачили зміну кольру індикатора
фенолфталеїна. Згадайте, як змінюють своє забарвлення інші індикатори у лужному
середовищі.
Під впливом якого йону індикатори змінюють своє
забарвлення у лужному середовищі?
Складіть рівняння реакцій дисоціації натрій
гідроксиду та кальцій гідроксиду.
Зверніть увагу на те, що кальцій гідроксид, хоча
і є малорозчинним, все одно вважається лугом.
Б)
Взаємодія лугів кислотами
Для лугів характерна
взаємодії з речовинами, що мають
протилежні властивості. Реакція між лугами та кислотами відбувається
відповідно схеми:
луг + кислота = сіль + вода.
До якого типу відноситься
ця реакція?
Як називають реакції, які
відбуваються між основою та кислотою?
https://www.youtube.com/watch?v=4xjvDx9-tFs ( дослід «Ввзаємодія натрій гідроксиду з
хлоридною кислотою»)
Складіть рівняння реакції взаємодії натрій
гідроксиду з нітратною кислотою в
молекулярній та йонно-молекулярній формах.
Луги реагують також з органічними кислотами. В 10 класі
ви вивчали взаємодію етанової (оцтової) кислоти з лугом.
2СН3СООН +
Са(ОН)2 = (СН3СОО)2Са + 2Н2О
сіль кальций етаноат
2СН3СООН + Са2+
+ 2ОН- = 2СН3СОО- + Са2+ + 2Н2О
2СН3СООН + 2ОН-
= 2СН3СОО- + 2Н2О
В) Взаємодія лугів з кислотними оксидами.
Луги реагують також з кислотними оксидами. Реакція відбувається відповідно схеми: луг + кислотний оксид = сіль + вода
Ви вже знайомі з цією реакцією. Під час взаємодії кальцій гідроксиду з карбон(IV) оксидом
спостерігається утворення білого осаду кальцій карбонату. Це якісна реакція на
вуглекислий газ.
Складіть рівняння реакції взаємодії кальцій
гідроксиду з карбон(IV) оксидом в
молекулярній та йонно-молекулярній формах.
Г) Взаємодія лугів з амфотерними оксидами та
гідроксидами.
Взаємодія лугів з амфотерними оксидами та гідроксидами
відбувається за схемою: луг + амфотерний
оксид (гідроксид) = сіль + вода
Наприклад натрій гідроксид реагує з цинк оксидом та цинк
гідроксидом:
А) при сплавленні, з утворенням солей цинкатів
2 NaOH + ZnO = Na2ZnO2 + H2О
2 NaOH + Zn(OH)2 = Na2ZnO2 + 2H2O
натрій цинкат
Б) в розчині, з
утворенням розчинної солі натрій тетрагідроксоцинкат.
2 NaOH(розчин) + Zn(OH)2 ↓=
Na2 [Zn[(ОН)4]+ 2H2O
натрій тетрагідроксоцинкат
2 Na+ + 2OH-
+ Zn(OH)2↓ = 2Na+ + [Zn[(ОН)4]2-+ 2H2O
2OH- + Zn(OH)2↓
= [Zn[(ОН)4]2-+ 2H2O
В цих реакціях цинк оксид
та цинк гідроксид виявляють властивості
кислот.
Д) Взаємодія з розчинами
солей.
В 9 класі ми вивчали умови проходження реакцій обміну в
розчинах електролітів.
Згадайте, за яких умов можливе проходження реакцій
обміну в розчинах електролітів.
Реакція між лугом та
сіллю відбувається за схемою:
луг + сіль1= сіль2 + основа
https://www.youtube.com/watch?v=SXXtiKSSRpM (дослід «Взаємодія ферум(ІІ) хлориду з натрій
гідроксидом»)
Чому ця реакція між розчинами електролітів відбувається
до кінця?
Складіть рівняння реакції
взаємодії натрій гідроксиду з ферум(ІІІ) хлоридом в молекулярній та йонно-молекулярній формах.
За якої ознаки ви
визначили, що утворився саме ферум(ІІІ) гідроксид?
З вивченого матеріалу ми
можемо зробити висновок: натрій гідроксид і кальцій гідроксид – це сильні
основи - луги, бо вони утворені лужним та лужноземельним металічними елементами
І та ІІ головних підгруп Періодичної системи хімічних елементів зі ступенями
окиснення +1 та +2. Типовими для цих сполук хімічними властивостями є :
взаємодія з кислотними та амфотерними оксидами (гідроксидами), кислотами та
розчинами солей за умови утворення осаду.
6.
Застосування натрій
гідроксиду та кальцій гідроксиду.
Натрій гідроксид широко використовується в промисловості
та побуті. В промисловості його використовують для очищення нафтопродуктів,
виробництва паперу та картону, косметичних засобів (мила, шампунів, мийних
засобів), фарб. У побуті натрій гідроксид використовують для прочищення
каналізаційних труб.
Цікавим фактом є те, що натрій гідроксид використовують як харчову добавку Е524 в харчовій промисловості Завдяки саме цій добавці маслини набувають темного кольору.
З давніх часів кальцій гідроксид (гашене вапно) використовували у будівництві. В суміші з камінням та піском його використовують як будівельний матеріал і зараз. У цукровій промисловості кальцій гідроксид використовується для очищення бурякового соку. У сільському господарстві - для зменшення кислотності ґрунтів та побілки дерев. Також він потрібен для виробництва дезінфікуючих засобів та відбілювачів.
Домашнє завдання:Опрацюйте матеріал підручника, сайту, відео.
Перевір, як ти засвоїв матеріал з теми, виконавши наступні завдання.
Виконайте завдання:
1. Які з перелічених речовин
реагуватимуть з натрій гідроксидом? Складіть рівняння відповідних реакцій в
молекулярній, повній та скороченій йонних формах.
Na, AI2O3, P2O5, ZnO, Na2CO3, Cu(OH)2, CO2.
2. Які з перелічених гідроксидів реагують з розчином натрій гідроксиду? Складіть
рівняння відповідних реакцій в молекулярній, повній та скороченій йонних формах..
Mg(ОН)2,
Cu(ОН)2, AI(ОН)3,
Zn(ОН)2, Ca(ОН)2.
3. Яку масу вапняку, що містить 90% кальцій карбонату, необхідно взяти для
одержання негашеного вапна масою 112 г? (
222 г)
1. Найпоширеніші метали та їхні сплави. Метали — речовини, що набули широкого застосування в промисловості й техніці завдяки своїм унікальним властивостям, зумовленим їхньою будовою. Залежно від властивостей, деякі з них використовують менше, а без деяких неможливий розвиток економіки країни.
Лужні метали натрій та калій, які добувають електролізом розплавів солей, лугів або оксидів цих металічних елементів, незважаючи на їхню високу активність, отримали промислове застосування в різних галузях. Металічні натрій та калій застосовують як каталізатори під час синтезу органічних сполук, зокрема синтетичного каучуку. За допомогою натрію в металургійній промисловості відновлюють кольорові метали, наприклад титан. Рівняння реакції:
TiCl4 + 4Na = Ti + 4NaCl.
Крім того, натрій використовують у ядерних реакторах як теплоносій.
Літій застосовують у фотоелементах завдяки здатності перетворюватися на позитивно заряджені йони під час його освітлення.
Кальцій, як і натрій, застосовують у металургії для добування важковідновлюваних металів, наприклад хрому з його оксиду:
Cr2O3 + 3Ca = 2Cr + 3CaO.
Цей метал використовують для виготовлення сплавів. На основі свинцю з добавкою кальцію добувають сплав, яким заливають підшипники залізничних вагонів.
Алюміній завдяки його властивостям: легкості, пластичності, електро- й теплопровідності та міцності, набув дуже широкого застосування (рис. 49).

Рис. 49. Схема застосування алюмінію
Сплави — це системи, утворені з двох або більше компонентів (металів з металами або металів з неметалами). Основою для виготовлення сплавів є залізо й алюміній, хром і мідь, магній та титан. З неметалів — бор, кремній та вуглець. Є також сплави розчини, сплави механічні суміші й сплави, у яких речовини реагують одна з одною з утворенням інтерметалідів.
Сплави розчини утворюють подібні за властивостями речовини. Різні за хімічними властивостями метали утворюють сплави механічні суміші. Сплави третього виду можуть не тільки змішуватися, а й утворювати між собою та з атомами неметалів різні сполуки.
Надтверді сплави виготовляють методом порошкової металургії. Суть методу полягає в пресуванні під високим тиском порошків металів, з подальшим їхнім спіканням. За фізичними властивостями сплави відрізняються від чистих металів міцністю, твердістю, нижчими температурами плавлення та кипіння, слабшою електро- й теплопровідністю.
Ознайомимося докладніше з найпоширенішими сплавами міді й алюмінію (кольорових металів) і заліза, що є основою чорної металургії.
Мідь та її сплави. Дізнайтеся про застосування міді та її сплавів, опрацювавши рис. 50.

Рис. 50. Схема застосування міді та її сплавів
Сплави алюмінію. Чистий алюміній не має високої міцності та твердості, тому частіше використовують його сплави. Для поліпшення механічних властивостей алюмінію добувають його сплави з міддю, магнієм і марганцем.
Найпоширеніші сплави алюмінію — це дюралюміни, силуміни й терміт.
Дюралюміни (від фр. dur — твердий; aluminium — алюміній) — сплави, що містять у своєму складі мідь (1,4-13 %), магній (0,4-2,8 %), манган (0,2-1 %), цинк (5-7 %), залізо (0,8-1,8 %), титан (0,02-0,35 %) і силіцій (0,5-6 %). Дюралюміни завдяки особливим властивостям — міцності, легкості, стійкості до корозії та теплопровідності — набули широкого застосування в авіа-, корабле- й ракетобудуванні.
Силуміни — сплави, які, крім алюмінію, мають високий вміст силіцію (3-26 %). До їхнього складу також входять магній (0,2-1,5 %), мідь (1-4 %), цинк (2-4 %), хром (0,2-0,4 %), нікель (0,8-2 %), титан (0,05-1,5 %). Їх використовують у виробництві машин для сільськогосподарських потреб, деталей багатьох приладів, коліс в авіа- й автомобілебудуванні.
Терміт — сплав алюмінію з ферум(ІІ, ІІІ) оксидом. Під час використання виділяє багато тепла, тож його застосовують для зварювання шин.
Залізо та його сплави. Чисте залізо має обмежене використання. Здебільшого застосовують сплави заліза — чавун і сталь.
Сировиною для виплавлення чавуну є залізні руди.
Пригадайте з курсу географії, що таке руди та де в Україні виявлені поклади залізних руд і розташовані металургійні заводи з переробки руди на важливі для металургії сплави.
Під час переробки залізних руд утворюються сплави заліза з вуглецем — чавун і сталь. Чавун — сплав, що містить у своєму складі 2-4 % Карбону та домішки мангану, сполук Фосфору, Силіцію та Сульфуру. Великий вміст Карбону в чавуні робить його крихким і нековким, хоча він твердіший, ніж залізо.
Сталь — сплав, у якому значно менший вміст Карбону (0,1-2 %) і домішок мангану, сполук Силіцію, Фосфору та Сульфуру. Менший вміст Карбону надає сталі більшої ковкості та пластичності. Тому її можна штампувати, прокатувати, кувати. Для поліпшення цих якостей сталь загартовують, тобто розжарену сталь швидко охолоджують. Гартована сталь значно твердіша. Водночас сталь з низьким вмістом Карбону загартовуванню не піддають. Для надання сталі певних якостей її легують, тобто додають до неї інші метали. Легувальними металами найчастіше є хром, вольфрам, нікель, ванадій, манган, молібден, меншою мірою — титан, кобальт, берилій. А з неметалів — силіцій. Застосування заліза та його сплавів подано в схемі на рис. 51.

Рис. 51. Схема застосування заліза та його сплавів
Отже, кольорова та чорна металургія становлять основу економіки країни.
Відомо, що в природі є майже 70 металів, і дотепер відкривають нові метали. Однак жоден з них не може зрівнятися за масштабами виробництва та застосування з алюмінієм, міддю, залізом і сплавами, добутими на їхній основі. Водночас майже всі метали певною мірою використовують у сучасних технологіях металургійної промисловості України.
Вагомий внесок у розвиток чорної та кольорової металургії зробили українські вчені. Відомі імена вчених-хіміків, металургів. Це, зокрема, М. Мозговой, який розробляв теоретичні основи киснево-конверторного процесу; І. Францевич, який працював над створенням нових металокерамічних матеріалів, металів із заданими властивостями та сплавів; І. Бардін, який запропонував практичне поліпшення металургійного виробництва: застосування кисню в доменному процесі, киснево-конверторний метод виробництва сталі, що інтенсифікувало процес добування чавуну та сталі.
Екологія та металургія. Під час металургійного виробництва й переробки руд утворюються отруйні гази, які потрапляють в атмосферу. Це відомі вам сульфур(IV), нітроген(IV) і карбон(IV) оксиди, що спричиняють випадання кислотних дощів; карбон(ІІ) оксид отруює повітря.
Крім газів, утворюється пил, який уловлюють за допомогою спеціальних пристроїв і фільтрів. У чорній металургії використовують велику кількість води для охолодження металів. Вода забруднюється, а водоочисні споруди не завжди забезпечують її повне очищення від шкідливих домішок. Унаслідок потрапляння відпрацьованої води в природні водойми шкідливі речовини забруднюють їх. Усі ці забруднення негативно впливають на довкілля, а отже, і на здоров'я людини, ріст і розвиток рослин і тварин.
Тому найважливішим завданням металургійної промисловості є впровадження безвідходних технологій. Це дасть змогу багаторазово використовувати відходи та здешевити виробництво багатьох продуктів промисловості. Прикладом безвідходної технології може бути використання сульфур(IV) оксиду для виробництва сульфатної кислоти.
ПІДСУМОВУЄМО ВИВЧЕНЕ
• Метали — речовини, що набули широкого застосування в промисловості й техніці завдяки своїм унікальним властивостям.
• Натрій та калій застосовують як каталізатори під час виробництва синтетичного каучуку, натрій — як теплоносій у ядерних реакторах; літій — у фотоелементах.
• Кальцій, як і натрій, — для добування важковідновлюваних металів і виготовлення сплавів у металургії.
• Сплави — системи з двох або більше компонентів (металів з металами або металів з неметалами).
• Алюміній утворює сплави: дюралюміни, силуміни й терміт. Дюралюміни застосовують в авіа-, корабле- й ракетобудуванні; силуміни — у виробництві машин для сільськогосподарських потреб, деталей багатьох приладів і коліс, авіа- й автомобілебудуванні; терміт — для зварювання шин.
• Мідь — як конструкційний матеріал, для виготовлення апаратури, електропроводів, речей домашнього вжитку, інструментів, художніх виробів, а також для добування її сплавів — латуні та різних видів бронзи.
• Латунь використовують у військовій та ювелірній справі, суднобудуванні, для виробництва труб, конденсаторів і радіаторів. З бронзи виробляють деталі для авіадвигунів і турбін, підшипників і пружин, побутові вироби, посуд.
• Залізо та його сплави — незамінні матеріали для промислових і житлових будівель, виробництва залізобетону та конструкцій мостів. Їх застосовують у машинобудуванні, як покрівельну жерсть, виготовляють інструменти та побутові вироби.
- збільшення радіуса атомів;
- зменшення електронегативності;
- посилення відновних, металічних властивостей.
- кам'яна сіль (натрій хлорид )
NaCl , - глауберова сіль, або мірабіліт — натрій сульфат декагідрат
Na2SO4⋅10H2O , - сильвін — калій хлорид
KCl , - сильвініт — калій-натрій хлорид
KCl⋅NaCl та інші.
У вільному вигляді прості речовини, утворені елементами

Сумарне рівняння реакції при електролізі розплаву натрій хлориду:
- натрій хлорид
NaCl (кам'яна сіль, кухонна сіль); - натрій карбонат
Na2CO3 (сода, кальцинована сода) та його кристалогідратNa2CO3⋅10H2O (кристалічна сода); - натрій гідрогенкарбонат
NaHCO3 (питна сода); - натрій сульфат
Na2SO4 та його кристалогідратNa2SO4⋅10H2O (глауберова сіль); - натрій нітрат
NaNO3 (натрієва селітра).
- калій хлорид
KCl (сильвін); - калій карбонат
K2CO3 (поташ); - калій нітрат
KNO3 (калійна селітра); - калій сульфат
K2SO4 .

ЛУЖНОЗЕМЕЛЬНІ МЕТАЛИ — хімічні елементи ІІ А групи періодичної системи Д.І. Менделєєва (див. Кальцій, Стронцій, Барій). Названі так тому, що оксиди — «землі» (за термінологією алхіміків) і надають воді лужної реакції.
В атомах цих елементів на зовнішньому енергетичному рівні містяться два s-електрони, тому в сполуках вони виявляють ступінь окиснення +2. У ряді елементів Ca, Sr, Ba, Ra закономірно зростають атомні та іонні радіуси, металічні властивості елементів та основні властивості оксидів та гідроксидів посилюються. Кальцій — біогенний елемент. Він сприяє згортанню крові, сповільнює дію токсинів, підвищує стійкість організму до інфекцій, знижує температуру тіла і збудливість окремих ділянок нервової системи, сприяє обміну Феруму. Солі Кальцію використовують при кровотечах і дитячій спазмофілії. Розчини солей Барію дуже токсичні. Барій міститься у кістках, артеріях, підшлунковій та наднирковій залозах, сироватці крові. Відносно багато його у сітківці ока людини, де Барій виконує роль флуоресціюючого екрана.
У фармації використовують барію сульфат як контрастну речовину при рентгенологічному дослідженні стравоходу, шлунка та кишечнику.
Д.З. Перегляньте відеоматеріали; вивчить матеріал підручника та сайту , складіть конспект.
Узагальнення
• Неметалічні елементи становлять майже 1/5 відомих хімічних елементів. У періодичній системі хімічних елементів вони розташовані наприкінці періодів за винятком 1 та 7 періоду і є елементами лише головних підгруп.
• Валентні електрони в атомах неметалічних елементів розташовані на підрівнях s та p на зовнішньому енергетичному рівні, тому під час хімічних реакцій зміни відбуваються лише на цьому рівні. Відтак атомам неметалічних елементів більш властиво утворювати спільні електронні пари або приєднувати електрони, аніж віддавати їх.
• Неметали — типові окисники. У сполуках з металічними елементами вони приєднують електрони (йонний хімічний зв'язок), у сполуках з неметалічними елементами утворюють спільні електронні пари (ковалентний хімічний зв'язок).
• У простих речовин неметалів відсутня виразна спільність фізичних властивостей. За нормальних умов серед них трапляються тверді речовини, рідини та гази, що мають різний колір, різну розчинність у воді, різну температуру кипіння. Найбільша спільність їх фізичних властивостей проявляється в тому, що утворені ними прості речовини не проводять електричний струм, тобто є діелектриками (виняток становлять графіт і силіцій).
• Неметалам властива алотропія — явище існування неметалічного елемента у вигляді кількох простих речовин.
• У хімічному відношенні неметали досить активні речовини. З металами вони утворюють бінарні сполуки, де мають негативний ступінь окиснення. З киснем неметали реагують з утворенням оксидів, у яких ступінь окиснення Оксигену дорівнює -2 (виняток становлять сполука з Флуором, пероксиди). Окрім кисню, неметали сполучаються з іншими неметалами. В утворених сполуках неметалічний елемент з меншою електронегативністю має позитивний ступінь окиснення, а неметалічний елемент з більшою електронегативністю — негативний ступінь окиснення.
• Солетворні оксиди неметалічних елементів належать до кислотних оксидів.
• Неметалічні елементи утворюють леткі сполуки з Гідрогеном. Хімічний зв'язок у молекулах цих речовин — ковалентний, кількість спільних електронних пар дорівнює кількості неспарених електронів в атомі неметалічного елемента, сполученого з Гідрогеном. Ці сполуки мають різну розчинність у воді. Добре розчиняється гідроген хлорид (хлороводень) з утворенням хлоридної кислоти, амоніак — з утворенням лугу амоній гідроксиду NH4OH, що дисоціює на амоній-катіон NH4+ і гідроксид-аніон ОН-.
• Катіон амонію входить до складу солей, що мають загальну назву «солі амонію». Катіони амонію можна визначити в розчині за допомогою лугу:
NH+4 + ОН- = NH3↑ + Н2О.
З'являється різкий запах амоніаку, зволожений індикаторний папірець синіє.
• Сульфатна H2SO4 і нітратна HNO3 кислоти у розчинах з низькою концентрацією виявляють усі загальні хімічні властивості кислот: змінюють колір індикаторів, утворюють солі (сульфати, гідрогенсульфати, нітрати відповідно), взаємодіючи з основними й амфотерними оксидами, основами й амфотерними гідроксидами.
• Якісною реакцією на сульфат-іони є утворення білого осаду нерозчинного у воді барій сульфату:
![]()
Для проведення якісної реакції використовують розчини речовин, які дисоціюють з утворенням катіона Барію Ва2+ (наприклад, барій хлорид, барій нітрат, барій гідроксид).
• Сульфатна та нітратна кислоти різної концентрації виявляють сильні окиснювальні властивості. Особливість окисно-відновних реакцій цих кислот з металами проявляється в тому, що продуктами реакцій є сіль, вода й один із продуктів відновлення кислоти (який саме — залежить від активності металу й концентрації кислоти).
• Для забезпечення повноцінного мінерального живлення рослин у ґрунт вносять мінеральні добрива — речовини або суміші речовин з високим умістом елементів живлення рослин. Промисловість виробляє найбільшу кількість азотних, калійних і фосфорних добрив.
• Народногосподарська діяльність людей (розвиток хімічних виробництв, транспорту, спалювання вугілля та газу на теплових електростанціях тощо) спричинюють порушення рівноваги в довкіллі, що стає причиною появи небажаних явищ — помітного зростання парникового ефекту, випадання кислотних дощів. За таких умов охорона довкілля набуває державного значення, стає особистісно значущою для кожної людини.
1. За основу сучасної класифікації хімічних елементів узято:
2. Максимальна кількість електронів на третьому енергетичному рівні дорівнює:
3. Позначте назву родини, яку складають елементи головної підгрупи сьомої групи періодичної системи хімічних елементів:
4. Укажіть рівняння реакції нейтралізації:
5. Установіть відповідність між класами сполуки і формулою:
1) кислота
2) нерозчинна основа
3) луг
4) сіль
а) K3PO4;
б) Al(OH)3;
в) CaO;
г) HCl;
д) NaOH.
6. Установіть відповідність між назвою та формулою солі:
1) калій сульфат
2) калій хлорид
3) калій ортофосфат
4) калій сульфід
а) K2SO4;
б) K3PO4;
в) KCl;
г) K2S;
д) K2SO4.
7. Установіть відповідність між вихідними речовинами та продуктами реакцій (рівняння реакції запишіть):
1) CO2 + К2O →
2) 2КCl + Н2C03 →
3) 3KOH + H3PO4→
4) P2O5 + 3К2O →
а) K3PO4 + 3H20;
б) К2C03;
в) К2C03 + 2НCl;
г) 2К3PO4;
д) К3PO4 + НСІ.
8. Здійсніть перетворення за схемою; запишіть відповідні рівняння реакції:
1. 2. 3. 4.
Al → Al2O3 → AlCl3 → Al(OH)3 → Al2O3.
8. Двовалентний метал масою 4 г розчинили у воді. При цьому виділився водень об’ємом 2,24 л (н.у.). Визначте цей метал.
10. Нітратна кислота масою 126 кг прореагувала з амоніаком об’ємом
60 м3 (н.у.). Обчисліть масу утвореного амоній нітрату.
11. Яку масу алюміній сульфіду можна одержати з 5,6 г алюмінію та 16 г сірки?
Особливості взаємодії нітратної кислоти з металами. Під час взаємодії з нітратною кислотою метали не витискають водень. З цією кислотою реагують активні метали й ті, що у витискувальному ряді металів стоять після водню. Залежно від концентрації кислоти, крім солей та води утворюються сполуки Нітрогену. Порівняємо, як відбувається взаємодія міді з концентрованою та розведеною нітратною кислотою (табл.
Таблиця
Взаємодія нітратної кислоти з міддю

Концентрована нітратна кислота реагує з усіма металами так само, як з міддю. Нітроген відновлюється до ступеня окиснення +4, тобто утворюється нітроген(ІV) оксид. Однак розведена й дуже розведена нітратна кислота по-різному реагує з активними й малоактивними металами. Нітроген відновлюється до різних ступенів окиснення: від -3 до +4
 Схема взаємодії нітратної кислоти різної концентрації з металами
Схема взаємодії нітратної кислоти різної концентрації з металами
Проаналізувавши рис дійдемо висновку, що більшість металів реагують з нітратною кислотою. За жодних умов не вступають у хімічну взаємодію платина, золото, родій, тантал та іридій. За звичайних температур (16-25 °С) алюміній, хром і залізо пасивуються під час контакту з нітратною кислотою. Суть процесу пасивування полягає в утворенні на поверхні металів тонких, дуже щільних захисних плівок оксидів алюмінію, хром(ІІІ) і ферум(ІІІ) оксидів, які з холодною нітратною кислотою не реагують.
Складіть самостійно рівняння реакцій взаємодії срібла з концентрованою та розбавленою нітратною кислотою.
Особливості взаємодії сульфатної кислоти з металами. Вам уже відомо, що розведена сульфатна кислота проявляє загальні властивості кислот. Під час таких реакцій Гідроген відновлюється й виділяється як проста речовина водень. Взаємодія концентрованої сульфатної кислоти характеризується тим, що під час цих реакцій відновлюється Сульфур. Концентрована сульфатна кислота реагує з металами, що в ряді активності розташовані до водню, і з тими, що після водню, зокрема міддю, ртуттю та сріблом. З металами, що стоять до водню, залежно від умов, Сульфур відновлюється до ступенів окиснення +4, 0 або -2. Під час взаємодії з міддю, ртуттю та сріблом — тільки до +4

Схема взаємодії концентрованої сульфатної кислоти з металами
Отже, нітратна й сульфатна кислоти під час взаємодії з металами проявляють специфічні властивості, вони є сильними окисниками. Під час взаємодії нітратної кислоти з металами Нітроген відновлюється до різних ступенів окиснення залежно від концентрації кислоти. Сульфур у концентрованій сульфатній кислоті відновлюється до різних ступенів окиснення залежно від активності металів.
ПІДСУМОВУЄМО ВИВЧЕНЕ
• Нітратна й концентрована сульфатна кислоти в реакціях з металами проявляють специфічні властивості: Нітроген і Сульфур, що входять до їхнього складу, є сильними окисниками.
• Концентрована нітратна кислота реагує з усіма металами, крім платини Pt, золота Au, родію Rh, танталу Ta й іридію Ir, відновлюючись до нітроген(IV) оксиду, у якому ступінь окиснення Нітрогену становить +4.
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ: п.21 підручника
- . Поясніть, як нітратна кислота взаємодіє з металами: а) концентрована з усіма металами; б) розведена з активними й малоактивними металами; в) дуже розведена з активними металами.
- . Позначте, до якого ступеня окиснення відновиться Сульфур, і вкажіть формулу сполуки, якщо срібло прореагує з концентрованою сульфатною кислотою.
- ладіть Ск рівняння реакцій за схемою: N2 → NO → NO2 → HNO3 → Mg(NO3)2
Карбон і його сполуки.
Алмаз має атомну кристалічну ґратку. Кожен атом Карбону в алмазі зв'язаний чотирма міцними ковалентними зв'язками з сусідніми атомами, розташованими у вершинах тетраедра.




З найдрібніших частинок графіту складаються сажа, деревне вугілля та кокс. Сажа утворюється при неповному згорянні палива. Деревне вугілля отримують при нагріванні деревини без доступу повітря, а кокс — переробкою кам'яного вугілля.
Деревне вугілля має пористу будову і має здатність поглинати гази і розчинені речовини. Така властивість називається адсорбцією.

- Взаємодія з металами.
- Взаємодія з воднем.
- Взаємодія з киснем.
- Взаємодія з оксидами металів.
- для обробки твердих поверхонь;
- для різання скла;
- для виготовлення бурів і свердел;
- для виготовлення ювелірних прикрас.
- при виготовленні олівців;
- як тверде мастило в підшипниках;
- для виготовлення електродів;
- як сповільнювач нейтронів в ядерних реакторах;
- для отримання штучних алмазів.
- входить до складу друкарської фарби, крему для взуття;
- використовується як наповнювач для виробництва гуми.
- в протигазах, промислових і побутових фільтрах;
- для очищення цукрового сиропу, спирту, тощо;
- в медицині.
https://www.youtube.com/watch?v=_MROdJkAWjs
Контрольні запитання
1. Схарактеризуйте валентні стани та можливі ступені окиснення Карбону.
2. Чому для атомів Карбону характерне утворення ковалентних зв'язків?
3. Схарактеризуйте поширеність у природі та біологічне значення Карбону.
4. Схарактеризуйте алотропні модифікаціїКарбону.
5. Яке вугілля називають активованим? Для чого його використовують?
6. Що таке адсорбція? Наведіть приклади цього явища і його застосування.
7. Схарактеризуйте хімічні властивості вуглецю.
8. Порівняйте будову алмазу і графіту та їхні властивості (колір, блиск, розчинність, твердість, крихкість, електропровідність).
9. Визначте ступені окиснення елементів у сполуках: CH4, CaC2, CO, HCOOH.
Термін «кислотні дощі» ввів в 1812 р. англійський інженер Роберт Сміт, в книжці «Повітря і дощ: початок хімічної клімтології».
Кислотний дощ утворюється в результаті реакції між водою і такими забруднюючими речовинами, як оксид сірки (SO2) і різних оксидів азоту (NOx). Ці речовини викидаються в атмосферу автомобільним транспортом, у результаті діяльності металургійних підприємств і електростанцій, а також при спалюванні вугілля і деревини. Вступаючи в реакцію з водою атмосфери, вони перетворюються в розчини кислот: сірчаної, сірчистої, азотистої й азотної. Потім, разом із снігом чи дощем, вони випадають на землю.
Кислотні дощі містять розчини сірчаної і азотної кислот, приносять значну шкоду природі. Ґрунт, водойми, рослинність, тваринність, стають їх жертвами. Кислотні дощі не тільки вбивають живу природу, а й розрушують пам’ятники архітектури. Міцний, твердий мармур, суміш кальцій оксиду та карбон (IV) оксиду (СаО і СО2), реагують з розчином сірчаної кислоти і перетворюються на гіпс (CaSO4). Зміна температури, потоки дощу і вітер розрушують цей м’який матеріал. Історичні пам’ятники Греції і Риму, простоявши тисячоліття, останніми роками руйнуються прямо на очах.
Страждають від кислотних дощів і люди, вимушені споживати питну воду, забруднену токсичними металами - ртуттю, свинцем, кадмієм. І тому рятувати природу від закислення необхідно. Для цього треба різко знизити викиди в атмосферу оксидів сірки і азоту. Ці дощі мають шкідливу дію на довкілля:
1. Урожайність знижується внаслідок ушкодження листя кислотами;
2. Спричиняють вимивання з ґрунту Кальцію, Калію, Магнію, що викликає деградацію фауни та флори;
3. Деградують та гинуть ліси (особливо кедр, бук, тис);
4. Отруюється вода озер і ставків, у яких гине риба (лосось, форель тощо) і численні види комах;
5. Зниження комах у водоймах призводить до зникнення птахів і тварин, які ними живляться;
6. Зникнення лісів у гірських районах (Карпати) зумовлює збільшення кількості гірських зсувів і селів;
7. Різко прискорюється руйнування пам’ятників архітектури, житлових будинків, оздоблених мармуром і вапняком;
8. Вдихання людьми повітря, забрудненого кислотним туманом, спричиняє захворювання дихальних шляхів, подразнення очей тощо.
Д.З. Перегляньте відеоматеріали; вивчить матеріал підручника п. 31-32 та сайту , Закінчити рівняння реакцій, визначити їх типи:
SO2+O2=
СаО + Н2O =
Р2O5 +Н20 =
Lі + Н20=
S03 + Н20 =
N2O5 +Н20 =






- з водою:
- з основними оксидами з утворенням солі ортофосфатної кислоти:
- з лугами з утворенням солі і води:

- з металами, які розташовані в ряду активності до водню:
- з основними оксидами:
- з основами
- з солями, якщо виділяється газ або осад:
- с амоніаком

- для виробництва мінеральних добрив,
- в якості харчової добавки в напоях,
- у виробництві синтетичних миючих засобів,
- на виробництві кормових добавок для тварин.
Фізичні властивості
Сульфатна кислота – безбарвна рідина, важка, майже вдвічі важча за воду, в’язка як олія. Змішується з водою у будь-яких співвідношеннях. При кімнатній температурі вона нелетка й тому не має запаху. Під час розчинення сульфатної кислоти у воді відбувається дуже сильне розігрівання за рахунок утворення стійких гідратів сульфатної кислоти. Якщо вливати воду в кислоту, то частина води, не встигнувши змішатися з кислотою, одразу нагрівається до кипіння. Це викликає розбризкування кислоти і може спричинити опіки
Концентрована сульфатна кислота поглинає багато вологи. Якщо відкриту склянку з концентрованою кислотою зрівноважити на терезах, то незабаром шалька зі склянкою опуститься. Тому цю кислоту використовують для висушування речовин. Концентрована кислота обвуглює папір і тканину. Потрапляючи на шкіру, вона спричиняє сильні опіки, тому під час роботи з кислотою необхідно бути дуже обережним. Кислоту, яка потрапила на шкіру або на тканину треба відразу змити великою кількістю води, потім розчином питної соди і знову змити водою.
Хімічні властивості
Сульфатна кислота – це сильна кислота. У водному розчині вона дисоціює за схемою: H2SO4 → H+ + HSO4–; HSO4– → H+ + SO42–.
Кислота змінює колір індикаторів: фіолетовий лакмус стає червоним, а метиловий оранжевий – рожевим. Розведена сульфатна кислота має загальні властивості характерні для всіх кислот: вона взаємодіє з металами, основними оксидами, основами та солями. Як двохосновна кислота, вона утворює два роди солей: середні і кислі в залежності від кількісного співвідношення речовин, що реагують.
Хімічні властивості сульфатної кислоти
1. Взаємодія з металами
Розведена сульфатна кислота взаємодіє з металами які в ряду активності стоять до водню, з виділенням водню й утворенням солі. Наприклад: H2SO4 + Zn = ZnSO4 + H2.
2. Взаємодія з основними оксидами
Сульфатна кислота взаємодіє з основними й амфотерними оксидами з утворенням солі й виділенням води, наприклад: CuO + H2SO4 = CuSO4 + H2O
або в йонно-молекулярній формі: CuO + 2H+ = Cu2++ H2O
Цей тип реакцій застосовують на металообробних заводах для очищення поверхні металевих виробів, які зазнавали в процесі виготовлення сильного нагрівання. Цю операцію називають травленням металу.
3. Взаємодія з основами
Сульфатна кислота взаємодіє з основами з утворенням солі й виділенням води,
наприклад: Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
або в йонно-молекулярній формі: Cu(OH)2 + 2H+ = Cu2+ + 2H2O.
4. Взаємодія з солями
Як сильна нелетка кислота сульфатна кислота витісняє інші кислоти із сухих солей. Наприклад: H2SO4 + 2KCl → К2SO4 + 2HCl↑.
=================
Сульфі́тна кислота́, також сірчи́ста кислота́ — хімічна сполука, яка має формулу H2SO3, нестійка кислота, що утворюється при розчинені діоксиду сірки у воді. Існує лише у водному розчині, і тому не виділена в вільному вигляді (на рисунку показана ампула з розчином сірчистого ангідриду у воді, розчин містить деяку кількість сірчистої кислоти).
Розчиняючись у воді, сульфітний ангідрид поступово взаємодіє з нею, утворюючи сульфітну кислоту:
Утворює два ряди солей: середні — сульфіти і кислі — бісульфіти. Сірчиста кислота та її солі є непоганими відновниками, особливо у лужному середовищі, що використовується для відновлення, наприклад, металічного срібла з розчину його аміакату. Але при взаємодії з ще сильнішими відновниками сірчиста кислота може виступати у ролі окиснювача:
При взаємодії з хлором вона легко відновлює його до хлороводневої кислоти, а сама окиснюється до сульфатної кислоти:
- https://youtu.be/P3VFNAO99nU - сульфідна кислота
Оксиди Нітрогену
Нітроген утворює п’ять оксидів зі ступенями окиснення від +1 до +5.
Різний кількісний склад оксидів і різна їх будова зумовлюють їх різні властивості. Усі оксиди Нітрогену дуже отруйні, за винятком нітроген(І) оксиду.
Формула оксиду
Нітрогену
Характер оксиду
Колір
Добування
Застосування
N2O
+1
Несолетворний
Газ
Безбарвний

Знеболюючий засіб у медицині, „звеселяючий” газ
NO
+2
Несолетворний
Газ
Безбарвний

Проміжний продукт виробництва нітратної кислоти
N2O3
+3
Кислотний
Рідина
Синій
NO + NO2 = N2O3
-
NO2
N2O4
+4
Кислотний
Газ
Тверда речовина
Бурий Безбарвний
2NO + O2 = 2 NO2
2NO2D N2O4
Окисник рідкого ракетного палива; каталізатор; очисник нафтопродуктів
N2O5
+5
Кислотний
Тверда речовина
Білий
2HNO3 + P2O5= N2O5 + 2HPO3
-
Серед них найбільше практичне значення мають нітроген(ІІ) оксид і нітроген(ІV) оксид.
- Нітратна (азотна) кислота
HNO3 — безбарвна рідина, з неприємним запахом, що димить на повітрі. При зберіганні на світлі вона розкладається і може забарвлюватися у жовтий колір за рахунок утворення бурого нітроген(IV ) оксиду:4HNO3=2H2O+4NO2↑+O2↑ . - Нітратна кислота змішується з водою у будь-яких співвідношеннях і у водному розчині повністю розпадається на йони:
HNO3→H++NO−3 .Загальні властивості кислотНітратна кислота реагує з основними і амфотерними оксидами і гідроксидами з утворенням нітратів:CuO+2HNO3=Cu(NO3)2+H2O ,Al(OH)3+3HNO3=Al(NO3)3+3H2O .Нітратна кислота вступає в реакції обміну з солями інших кислот, якщо утворюється газ або осад:CaCO3+2HNO3=Ca(NO3)2+H2O+CO2↑⏐ .Особливі властивостіНа відміну від інших кислот нітратна кислота реагує з більшістю металів, крім благородних.Зверни увагу!У реакціях нітратної кислоти з металами ніколи не утворюється воденьОкисником в цих реакціях виступає атом Нітрогену кислотного залишку, тому продуктами реакції є сполуки Нітрогену в різних ступенях окиснення. Склад сполук залежить від активності металу і концентрації нітратної кислоти. Так, при взаємодії концентрованої нітратної кислоти з міддю утворюється бурий нітроген(IV ) оксид:4HN+5O3+Cu0=Cu+2(NO3)2+2N+4O2+2H2O . - При взаємодії розведеної нітратної кислоти з міддю продукт реакції — безбарвний нітроген(
II ) оксид:8HN+5O3+3Cu0=3Cu+2(NO3)2+2N+2O+4H2O . Активніші метали можуть відновити нітратну кислоту д нітроген(
Активніші метали можуть відновити нітратну кислоту д нітроген(I ) оксиду, азоту або навіть до амоніаку: 3Zn+8HNO3(30%)=3Zn(NO3)2+2NO↑⏐+4H2O;
- не взаємодіє з
Pt,Ir,Ru,Rh,Pd,Au , на холоді ізFe,Cr,Al ; - з іншими важкими металами утворюється нітроген(
IV ) оксидNO2 ; - з лужними та лужноземельними металами утворюється нітроген(
I ) оксидN2O .
- з лужними та лужноземельними металами, а також з
Fe,Zn утворюється амоніак (амоній нітрат); - з важкими металами утворюється нітроген(
II ) оксидNO ; - з
Al sMg утворюється нітроген(I ) оксидN2O .
H2 + Cl2 = 2HCl (гідроген хлорид, або хлороводень);
N2 + 3H2= 2NH3 (гідроген нітрид, або амоніак);
Н2 + S = H2S (гідроген сульфід, або сірководень).
Загальноприйнято, що у формулі бінарної сполуки першим записують символ елемента з позитивним ступенем окиснення. Проте сполуку Нітрогену з Гідрогеном традиційно продовжують записувати NH3, хоча електронегативність Нітрогену значно більша за електронегативність Гідрогену.
• Пригадайте з органічної хімії, що метан (летка сполука Карбону з Гідрогеном) погано розчиняється у воді. Тому на болотах можна спостерігати бульбашки метану, що утворюється під водою з решток організмів унаслідок їх гниття без доступу кисню.
Леткі сполуки неметалічних елементів з Гідрогеном мають різну розчинність у воді.
Метан CH4, силан SiH4 погано розчиняються у воді.
Розчини добре розчинних у воді сполук неметалічних елементів з Гідрогеном виявляють властивості кислот або лугів. Зокрема, розчини гідроген хлориду й гідроген сульфіду — кислоти, розчин гідроген нітриду (амоніаку) — луг.
Особливості розчинення у воді гідроген хлориду й амоніаку. На підставі електронної будови атомів Хлору й Нітрогену, розглянемо електронні та структурні формули продуктів їхньої взаємодії з Гідрогеном.
Атому Хлору достатньо утворити одну спільну електронну пару з одним атомом Гідрогену, щоб зовнішній енергетичний рівень обох атомів став завершеним:
![]()
Атом Нітрогену за рахунок трьох неспарених електронів зовнішнього енергетичного рівня утворює три спільні електронні пари з трьома атомами Гідрогену, і зовнішній енергетичний рівень кожного з атомів стає завершеним:

Вид хімічного зв'язку в обох сполуках — ковалентний полярний. Спільні електронні пари зміщені в бік більш електронегативних атомів Хлору та Нітрогену.
Бінарні сполуки Гідрогену з неметалічними елементами утворені ковалентними полярними зв'язками.
ФІЗИЧНІ ВЛАСТИВОСТІ ГІДРОГЕН ХЛОРИДУ. Гідрогенхлорид HCl — газ без кольору, з різким запахом, подразливо діє на дихальні шляхи, «димить» на повітрі через те, що з парами води, які завжди присутні в повітрі, утворює дрібні краплі хлоридної кислоти. Гідроген хлорид добре розчиняється у воді (за температури 20 °С приблизно 500 л гідроген хлориду розчиняється в 1 л води).
ФІЗИЧНІ ВЛАСТИВОСТІ АМОНІАКУ. Амоніак NH3 — газ без кольору, з різким запахом, токсичний. Вдихання його в малих дозах допомагає вивести людину зі стану непритомності. У дозах, що перевищують гранично допустимі (у повітрі 0,04 мг/м3), спричинює ураження очей і набряк легень, ушкоджує нервову систему. Це газоподібна речовина з найбільшою серед відомих газів розчинністю у воді (за температури 20 °С близько 700 л амоніаку розчиняється в 1 л води). Відомий у медичній практиці нашатирний спирт (мал. 38) є водним розчином амоніаку з масовою часткою розчиненої речовини 10 %.

Мал. 38. Розчин амоніаку (нашатирний спирт)
ОСОБЛИВОСТІ ВОДНОГО РОЗЧИНУ ГІДРОГЕН ХЛОРИДУ. Порівнявши розчинність у воді амоніаку й гідроген хлориду, з якого виготовляють хлоридну кислоту, робимо висновок, що обидві сполуки добре розчинні у воді, проте утворені розчини мають різне середовище. Пояснюється це відмінностями в наслідках розчинення амоніаку NH3 та гідроген хлориду HCl у воді. У молекулі амоніаку зв'язки не руйнуються, а за рахунок вільної пари електронів атома Нітрогену до нього приєднується катіон Гідрогену Н+, утворений унаслідок дисоціації води. У хлороводню зв'язок між атомами Гідрогену і Хлору руйнується (пригадайте електролітичну дисоціацію сполук з ковалентним полярним зв'язком), утворені катіони Н+ та Cl- переходять у розчин, де катіон Гідрогену приєднується до молекули води:
HCl ⇄ Н+ + Cl-
Н2О + Н+ ⇄ Н3О+ (катіон гідроксонію)
Примітка: у рівняннях реакцій йонного обміну за участю кислот зазвичай записують Н+, а не Н3О+.
Як бачимо, хлоридна кислота є водним розчином гідроген хлориду. Вам відомо, що вона виявляє всі загальні властивості кислот, зокрема, діє на індикатори: універсальний індикаторний папірець, лакмус, метиловий оранжевий у ній набувають червоного кольору.
Тобто електролітична дисоціація гідроген хлориду відбувається з утворенням Гідроген-катіонів.
ОСОБЛИВОСТІ ВОДНОГО РОЗЧИНУ АМОНІАКУ. Дізнатися, що собою являє розчин амоніаку, можна дослідним шляхом. До отвору наповненої амоніаком пробірки підносять спершу сухий, потім — зволожений лакмусовий папірець. Сухий залишається без змін, а зволожений одразу набуває синього кольору. Тобто виявляє лужне середовище.
З'ясуємо, звідки у розчині амоніаку виникло лужне середовище, розглянувши фізико-хімічну суть розчинення амоніаку у воді.
Хоча вода й належить до слабких електролітів, окремі її молекули дисоціюють на Гідроген-катіон H+ і гідроксид-аніон ОН-:
Н2О ⇄ Н+ + ОН-.
У процесі розчинення амоніаку у воді Гідроген-катіон приєднується до атома Нітрогену за рахунок наявності в нього вільної пари електронів, утворюючи позитивно заряджений амоній-катіон NH+4 (у разі потреби повторіть тему 2).
![]()
Таким чином між катіоном Гідрогену й амоніаком утворюється ковалентний зв'язок за донорно-акцепторним механізмом, а в розчині накопичуються вільні гідроксид-аніони. За складом амоній гідроксид — основа, яка за здатністю розчинятися у воді належить до лугів і є слабким електролітом.
Водний розчин амоніаку має лужне середовище, зумовлене дисоціацією утворюваного амоній гідроксиду.
АМОНІЙ ГІДРОКСИД NH4OH — незвична основа. По-перше, у нього відсутній катіон металічного елемента, натомість до його складу увійшли п'ять атомів двох неметалічних елементів. По-друге, він існує лише в розчині. По-третє, належить до слабких електролітів, оскільки самочинно розкладається на воду й амоніак.
NH3 + HCl = NH4Cl
Одновалентний катіон амонію NH+4 може утворювати солі, що дістали назву солей амонію. Назва цих солей складається зі слова «амоній» і назви кислотного залишку в називному відмінку, звідки, NH4Cl — амоній хлорид, NH4NO3 — амоній нітрат, (NH4)2SO4 — амоній сульфат.
Солі амонію — кристалічні, добре розчинні у воді сполуки. Майже всі солі амонію є сильними електролітами, що у водних розчинах дисоціюють з утворенням катіонів амонію й аніонів відповідних кислотних залишків:
![]()
ЯКІСНА РЕАКЦІЯ З ВИЗНАЧЕННЯ В РОЗЧИНАХ ЙОНІВ АМОНІЮ. Достатньо за звичайних умов до розчину солі амонію додати розчин лугу, як відразу з'явиться запах амоніаку. Орган чуття людини (ніс) дуже чутливий до нього й відразу виявить утворення амоніаку.
• Пригадайте правила безпеки щодо того, як правильно нюхати речовини.
Не варто покладатись на нюх, достатньо над стаканом, у якому відбувається взаємодія солі амонію з лугом, потримати вологий лакмусовий папірець (мал. 40).

Мал. 40. Якісна реакція на солі амонію
Розглянемо хімічні процеси, щоб зрозуміти, звідки з'явився амоніак.

• Оксиди — бінарні сполуки будь-якого елемента з Оксигеном, ступінь окиснення якого -2.
• Розрізняють несолетворні й солетворні оксиди. До несолетворних належать CO, NO, SiO, N2O та деякі інші.
• За хімічними властивостями оксиди поділяють на основні, кислотні, амфотерні.

• Найактивніші неметалічні елементи й Гідроген утворюють із киснем також пероксиди (Na2O2, К2О2, ВаО2, Н2О2 та інші).
ХАРАКТЕРИСТИКА ХІМІЧНИХ ВЛАСТИВОСТЕЙ ОКСИДІВ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ.
Хімічні властивості оксидів | ||
Основні оксиди | Амфотерні оксиди | Кислотні оксиди |
1. Взаємодія з водою | ||
Утворюють луги (не всі) | — | Утворюють кислоти |
2. Взаємодія з кислотами | ||
Утворюють сіль і воду | Утворюють сіль і воду | — |
3. Взаємодія з лугами | ||
— | Утворюють сіль і воду | Утворюють сіль і воду |
4. Взаємодія з оксидом іншої групи | ||
Утворюють сіль | Утворюють сіль | Утворюють сіль |
ОДЕРЖАННЯ ОКСИДІВ НЕМЕТАЛІЧНИХ І МЕТАЛІЧНИХ ЕЛЕМЕНТІВ. Про утворення гідроген оксиду (вода), карбон(IV) оксиду (вуглекислий газ), силіцій(IV) оксиду (кварцовий пісок), оксидів Феруму та деяких інших, подбала природа.
Відомо три способи одержання оксидів.
1-й спосіб — окиснення відповідних простих речовин киснем.
С + О2 → СО2
Al + O2 → Аl2О3
Ca + O2 → CaO
2-й спосіб — окиснення бінарних сполук киснем.
ZnS + O2 → ZnO + SO2
CH4 + O2 → CO2 + H2O
3-й спосіб — термічний розклад деяких речовин (нерозчинних у воді карбонатів, нерозчинних основ, амфотерних гідроксидів).

АНТРОПОГЕННІ Й ПРИРОДНІ ПРИЧИНИ ПОЯВИ В АТМОСФЕРІ ОКСИДІВ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ. Вам відомі об'ємні частки газів у повітрі. Пригадати їх допоможе діаграма (мал. 41).

Мал. 41. Діаграма складу повітря
Нині, в умовах стрімкої урбанізації, уміст в атмосфері вуглекислого газу і води збільшується через антропогенні чинники (спалювання пального у двигунах транспортних засобів, на теплових електростанціях, заводах тощо).
Окрім водяної пари й вуглекислого газу, в атмосферу потрапляють сотні тисяч тонн інших речовин, зокрема й оксидів. Тобто до природних джерел надходження в атмосферу оксидів неметалічних елементів додаються антропогенні. Це створює загрозу природі через виникнення парникового ефекту й кислотних дощів.
Парниковий ефект — явище в атмосфері Землі, зумовлене тим, що молекули наявних у ній газів перешкоджають сонячним променям, що відбилися від поверхні Землі, повертатись у Космос (мал. 42). Цим самим підтримується рівновага між теплом Сонця, яке досягає поверхні Землі, і тепловим випромінюванням земної поверхні. За оцінкою вчених, без парникового ефекту температура Землі була б на 25-30 °С нижчою, аніж є насправді.

Мал. 42. Парниковий ефект
Наявні в повітрі водяна пара, вуглекислий газ, озон, метан впливають на цю рівновагу. Вони функціонують як скло в теплицях, що дає змогу сонячним променям потрапляти в неї й затримує інфрачервоні промені, забезпечуючи сприятливу для росту рослин температуру. За таку дію вони дістали назву «парникові гази».
Основними парниковими газами в атмосфері Землі є водяна пара (H2O), вуглекислий газ (CO2), озон (O3), нітроген(N) оксид (N2O), метан (CH4).
Помірний парниковий ефект створює сприятливі температурні умови для життя на нашій планеті, не допускає її переохолодження. Збільшуючи викиди парникових газів в атмосферу (робота транспорту, спалювання палива у великій кількості, виробництво електроенергії тощо), вирубуючи ліси, люди порушують тепловий баланс, що встановився впродовж віків. Лісові пожежі й виверження вулканів теж призводять до збільшення кількості вуглекислого газу в атмосфері. Зі збільшенням концентрації парникових газів посилюється парниковий ефект і підвищується температура на нашій планеті. Потепління загрожує таненням льодовиків і снігів у зоні вічної мерзлоти, що в подальшому може спричинити небажане підняття рівня води у Світовому океані.
- 1. Спрогнозуйте: а) наслідки для Землі відсутності парникового ефекту; б) суттєве збільшення в атмосфері Землі парникових газів.
- 2. Складіть рівняння можливих хімічних реакцій.
Н2О + Р2О5 →
Н2О + ZnO →
Н2О + SO3 →
СаО + ВаО →
ВаО + SO2 →
Д.З. Перегляньте відеоматеріали; вивчить матеріал підручника та сайту
НАЗВИ І ФОРМУЛИ НЕМЕТАЛІВ. Прості речовини, утворені атомами неметалічних елементів, мають загальну назву неметали. Про неметали — водень, кисень, азот, хлор, бром — ви дізнались в основній школі. За сучасною українською хімічною номенклатурою назви неметалів пишуть з малої літери й вони не завжди збігаються з назвами відповідних їм неметалічних елементів. Дізнайтеся про це більше, опрацювавши таблицю 5, і зверніть увагу, що не всі неметали мають одноатомні молекули.
Таблиця 5
Назви неметалів і неметалічних елементів за сучасною українською хімічною номенклатурою
хімічний елемент | Проста речовина | Хімічний елемент | Проста речовина | ||||
Символ | Назва | Назва | Молекулярна формула | Символ | Назва | Назва | Молекулярна формула |
H | Гідроген | водень | Н2 | Br | Бром | бром | Вr2 |
N | Нітроген | азот | N2 | I | Йод | йод | І2 |
O | Оксиген | кисень озон | O2 O3 | C | Карбон | вуглець (графіт, алмаз, карбін) | С |
F | Флуор | фтор | F2 | Si | Силіцій | силіцій | Si |
Cl | Хлор | хлор | Cl2 | S | Сульфур | сірка | S |
ПОШИРЕННЯ НЕМЕТАЛІВ У ПРИРОДІ. Неметали більш поширені в природі, аніж метали, проте у вільному стані трапляються не всі. Неметали азот, кисень, інертні гази — це основні речовини у складі повітря. Поклади самородної сірки в Передкарпатті — одні з найбільших у світі. Промисловим родовищем графіту в Україні є Завалівське родовище, сировину якого використовує Маріупольський графітовий комбінат. У деяких регіонах України виявлені поклади порід, які можуть містити алмази (зокрема, у Житомирській області, на Волині), проте промислові родовища поки що не розвідані.
Значно більше неметалічних елементів існують у вигляді складних речовин, серед яких домінують оксиди та солі.
ЗАГАЛЬНІ ФІЗИЧНІ ВЛАСТИВОСТІ НЕМЕТАЛІВ. За нормальних умов неметали — водень Н2, фтор F2, хлор Cl2, кисень O2, озон О3, азот N2 і благородні гази (гелій He, неон Ne, аргон Ar, криптон Kr, ксенон Xe, радон Rn) — перебувають у газоподібному агрегатному стані, бром Вr2 — рідкому, решта неметалів — тверді речовини.
Неметали (мал. 27 на с. 28) відрізняються за кольором і запахом. Так, водень, кисень, азот — безбарвні гази без запаху; фтор — блідо-жовтий, а хлор — жовто-зелений (до того ж отруйні гази з різким специфічним запахом). Бром — темно-червона отруйна рідина, жовто-бурі пари якої мають різкий, подразливий запах. Фосфор червоний — тверда речовина червоного кольору без запаху, фосфор білий — тверда отруйна речовина білого кольору з характерним часниковим запахом. Серед неметалів твердими без запаху речовинами є сірка (жовтий колір) і йод (чорно-фіолетова речовина з металічним блиском).
 Зразки неметалів: а — хлор; б — червоний фосфор; в — бром; г — йод; д — кисень рідкий; е — азот рідкий
Зразки неметалів: а — хлор; б — червоний фосфор; в — бром; г — йод; д — кисень рідкий; е — азот рідкий
Оскільки неметали за нормальних умов можуть перебувати в різних агрегатних станах, то й температури їх плавлення та кипіння мають широкий діапазон. Газоподібні неметали (водень, кисень, азот) киплять за низьких температур (майже -200 °С). Тверда речовина йод при нагріванні сублімується — відразу переходить із твердого стану в газоподібний. (мал. 28). Для того щоб розплавити сірку, достатньо температури полум'я спиртівки чи сухого пального (мал. 29), тоді як одна з алотропних модифікацій Карбону — алмаз — має температуру плавлення понад 3000 °С.

Мал. 28. Сублімація йоду

Мал. 29. Плавлення сірки
Більшість неметалів не проводять електричний струм, тобто є діелектриками, але існують і винятки. Так, силіцій Si — напівпровідник, а графіт C — провідник електричного струму. Неметали, що за нормальних умов перебувають у твердому стані, погано проводять тепло, крихкі, розчинність у воді не є їхньою характерною загальною властивістю. Серед газоподібних неметалів немає жодного, який би добре розчинявся у воді. Проте багато з них добре розчинні в органічних розчинниках. Найкращу розчинність у воді мають галогени. Розчин брому у воді відомий вам під назвою «бромна вода».
• Обчисліть густину за повітрям гелію та хлору. Яка кулька — наповнена за однакових умов гелієм чи хлором — стрімко підніматиметься вгору?
• Пригадайте, що вам відомо про застосування кисню. Яка біологічна роль кисню?
Серед газоподібних неметалів чимало легших за повітря.
Неметали мають різноманітне застосування. Ознайомитися з ним допоможе малюнок 30 на с. 80.
АДСОРБЦІЯ. На малюнку 30 в описі застосування вуглецю подано новий для вас термін — адсорбція. Адсорбція — це здатність деяких речовин (адсорбентів), зокрема вуглецю, утримувати на своїй поверхні частинки газу або розчиненої речовини. До того ж адсорбент не змінюється, а лише утримує на своїй поверхні газ чи рідину за рахунок притягувальних сил між окремими частинками. Внаслідок цього концентрація утримуваної речовини в об'ємі, що межує з адсорбентом, зростає.
Адсорбція — вибіркове поглинання речовини з газового чи рідкого середовища поверхнею твердого тіла.
На адсорбційній здатності вуглецю базується його використання в медицині — це пігулки або капсули активованого вугілля. Їх застосовують внутрішньо в разі отруєння.
Ученим Національної академії наук України В. В. Стрелко, В. Г. Ніколаєву, М. Т. Картелю належить створення адсорбентів медичного призначення, зокрема вуглецевих гемосорбентів «КАРБОН». Їх використовують для очищення крові поза організмом у разі отруєнь і різних тяжких захворювань.
В Україні створено Інститут сорбції та проблем ендоекології НАН України, учені якого працюють над створенням сорбційних матеріалів для медицини, захисту довкілля.
Переконайтеся в адсорбційній здатності вугілля, виконавши лабораторний дослід з рубрики «Хімія — це життя: сторінка природодослідника».

Застосування неметалів
Хімія — це життя: сторінка природодослідника
Експериментуємо дома:
Дослідження адсорбційної здатності активованого вугілля й аналогічних лікарських препаратів
Завдання 1. Виготовте розбавлений розчин чорнила чи йодної настоянки.
Завдання 2. У хімічний стакан помістіть 2-3 пігулки активованого вугілля (відпускається в аптеках без рецепту) і долийте до нього виготовлений розчин, перемішуючи скляною паличкою. Спостерігайте за вмістом стакана. Занотуйте результати спостереження.
Завдання 3. За можливості дослід повторіть з іншими лікарськими препаратами, що мають високу адсорбційну здатність, або подрібненим деревним вугіллям.
На початку ХХ ст. Микола Дмитрович Зелінський використав адсорбційну здатність вуглецю у винайденому ним вугільному протигазі для захисту органів дихання, обличчя й очей людини від дії шкідливих речовин, що потрапили в атмосферу. Завдяки цьому винаходу було врятовано життя сотень тисяч солдатів під час Першої світової війни.
Удосконалений протигаз (мал. 31) застосовується й нині.

Протигаз: 1 — коробка з адсорбентом; 2 — гумовий шолом
Д.З. Перегляньте відеоматеріали; вивчить матеріал підручника та сайту
У попередніх класах ви вже вивчали склад, поширеність, електролітичну дисоціацію та властивості солей. Але ви ознайомилися лише із середніми солями. Також існують кислі та основні солі, які відрізняються від середніх складом і певними властивостями.
• Середні солі складаються тільки з катіонів металічних елементів та аніонів повністю дисоційованих кислот, наприклад K2CO3 та Na2SO4.
• Основні солі відрізняються від середніх наявністю гідроксид-іонів. Вони можуть бути утворені багатозарядним катіоном та будь-яким аніоном:

• Кислі солі відрізняються від середніх наявністю Гідрогену. Вони можуть бути утворені будь-яким катіоном, а аніон може бути лише від багатоосновної кислоти, оскільки кислі солі є продуктом неповного заміщення атомів Гідрогену в молекулі кислоти катіонами металічних елементів:

Складають формули кислих солей, ґрунтуючись на зарядах катіонів та аніонів. У назвах кислих солей наявність H+ позначають префіксом «гідроген» у назві аніону.

Взаємодія солей із водою. Поняття про гідроліз
Коли ми говоримо про взаємодію солей із водою, то зазвичай маємо на увазі процес розчинення солей у воді. Але експериментально встановлено, що розчини деяких солей не змінюють забарвлення індикаторів, а в розчинах інших солей індикатори показують наявність кислот або лугів. Звідки ж у розчині солі наявні луг або кислота? Вони з'являються в результаті хімічної взаємодії солей із водою, що називають гідролізом.
• Гідроліз солей — це хімічна взаємодія йонів солі з водою, у результаті якої утворюється слабкий електроліт (кислота або основа).
Можна виділити декілька видів гідролізу. Насамперед — оборотний та необоротний гідроліз. У разі оборотного гідролізу з водою взаємодіє не більше декількох відсотків розчиненої солі, а в разі необоротного майже вся речовина піддається гідролізу. В оборотному гідролізі також можна виділити три види, залежно від того, якою кислотою і якою основою утворена сіль.

Гідроліз солей, утворених слабкими кислотами та сильними основами
Сіль, утворена сильною основою та слабкою кислотою, піддається гідролізу за аніоном, а її розчин має лужне середовище, pH > 7
Солі, утворені слабкими кислотами та сильними основами, у розчині піддаються гідролізу за аніоном. Наприклад, натрій флуорид взаємодіє з водою за рівнянням:
NaF + H2O ⇄ NaOH + HF
Цей процес відбувається дуже слабко, гідролізу піддається не більше одного відсотка розчиненої солі, утім, невелика кількість продуктів реакції з'являється в розчині. До того ж із двох продуктів реакції натрій гідроксид — сильна основа, тобто повністю дисоціює на йони, а флуоридна кислота — слабка кислота, тобто дисоціює слабко. Отже, у розчині з'являється надлишок гідроксид-іонів, що зумовлює лужне середовище. У йонній формі рівняння реакції гідролізу натрій флуориду буде таким:
F- + H2O ⇄ OH- + HF
Скорочене йонне рівняння набагато краще ілюструє надлишок гідроксид-іонів. Під час його складання необхідно пам'ятати, що у вигляді йонів записують тільки сильні електроліти, а слабкі електроліти — у вигляді молекул. Зі скороченого рівняння видно, що сіль, утворена сильною основою та слабкою кислотою, піддається гідролізу за аніоном, тобто за йоном кислотного залишку.
Як ви знаєте, багатоосновні кислоти дисоціюють ступінчасто, а отже, і солі багатоосновних кислот піддаються ступінчастому гідролізу. Наприклад, натрій карбонат за першою стадією взаємодіє з однією молекулою води, а продукт гідролізу взаємодіє з іншою молекулою води.
Перша стадія:
![]()
Друга стадія:

Сумарне рівняння:
![]()
За першою стадією гідролізу піддається близько 2 % розчиненої солі, а за другою — менше 0,01 %. Отже, як і для дисоціації, так і для гідролізу справедливим є твердження: якщо процес відбувається за декількома стадіями, то ефективніше відбувається процес за першою стадією.
Гідроліз солей, утворених сильними кислотами та слабкими основами
Солі, утворені сильними кислотами та слабкими основами, піддаються гідролізу за катіоном. Прикладом такої солі є амоній хлорид NH4Cl, що взаємодіє з водою:
NH4Cl + H2O ⇄ NH4OH + HCl
Сіль, утворена слабкою основою та сильною кислотою, піддається гідролізу за катіоном, а її розчин має кислотне середовище, pH < 7
Під час гідролізу утворюються сильна хлоридна кислота, яка повністю дисоціює, та слабка основа — гідрат амоніаку NH4OH (або ΝΗ3 • Η2Ο). Це зумовлює появу надлишкової кількості йонів Н+, що визначає кислотне середовище в розчині:
![]()
Отже, солі, утворені слабкими основами, піддаються гідролізу за катіоном.
Якщо сіль містить багатозарядні катіони металічного елемента, то гідроліз може відбуватися за декількома стадіями, але в реальності зазвичай відбувається реакція лише за першою стадією:
CuCl2 + H2O ⇄ CuOHCl + HCl
Cu2+ + H2O ⇄ CuOH+ + H+
Гідроліз солей, утворених слабкими кислотами та слабкими основами
Солі, утворені слабкими кислотами та слабкими основами, піддаються гідролізу як за катіоном, так і за аніоном. У водному розчині такої солі в результаті гідролізу утворюються два слабкі електроліти. Так гідролізується, наприклад, амоній карбонат:

Сіль, утворена слабкою основою та слабкою кислотою, піддається гідролізу як за катіоном, так і за аніоном. Кислотність розчину визначається тим, який з утворених електролітів сильніший. Якщо сильнішою є кислота, то середовище кислотне, а якщо сильнішою є основа — лужне
Для того щоб визначити кислотність середовища в такому розчині, необхідні додаткові відомості про силу утворених електролітів. Із довідкової літератури можна дізнатися, що гідрат амоніаку сильніший електроліт за гідрогенкарбонат-іон. Отже, він дисоціює ефективніше, що спричиняє надлишок гідроксид-іонів і зумовлює лужне середовище в розчині амоній карбонату. Однак, щоб дійти таких висновків, необхідні відомості про силу кислот і основ, які наведено в спеціальній літературі.
Цікавим прикладом солі, утвореної слабкими кислотою й основою, є амоній етаноат CH3COONH4. Під час гідролізу цієї солі утворюються також два слабкі електроліти, але їхня сила майже однакова:
CH3COONH4 + H2O ⇄ CH3COOH + NH4OH
Тому в розчині амоній етаноату немає надлишку ані йонів Гідрогену, ані гідроксид-іонів. У розчині амоній етаноату середовище нейтральне. Цей факт може спонукати до висновку, що в цьому випадку гідроліз не відбувається, але це не так. Гідроліз відбувається, йому піддається майже 3 % розчиненої солі, проте завдяки однаковій силі утворених електролітів концентрація йонів Н+ та OH- однакова, що є ознакою нейтрального середовища.
Сіль, утворена сильною кислотою та сильною основою
Сіль, утворена сильною основою та сильною кислотою, гідролізу не піддається, а в її розчині нейтральне середовище, pH = 7
Для розчиненої у воді солі, що утворена сильною кислотою і сильною основою, наприклад натрій хлориду NaCl, можна було б записати рівняння:
NaCl + H2O = NaOH + HCl
Але обидва продукти реакції є сильними електролітами і у вигляді молекул у розчині існувати не можуть. Отже, така реакція не відбувається.
У цьому можна переконатися, якщо скласти рівняння гідролізу в йонній формі: усі йони в цьому рівнянні скоротяться.
Отже, солі, утворені сильною кислотою і сильною основою, гідролізу не піддаються, у їхніх розчинах середовище нейтральне.
Необоротний гідроліз
Солі, утворені леткою слабкою кислотою та нерозчинним у воді гідроксидом, піддаються необоротному гідролізу
Усі розглянуті вище випадки гідролізу є прикладами оборотних процесів. Вони не можуть відбуватися до кінця, оскільки продукти реакції, накопичившись у значних кількостях, починають взаємодіяти один з одним, утворюючи початкові речовини.
Інша ситуація із солями, утвореними леткими кислотами та нерозчинними гідроксидами: під час їх гідролізу утворюються речовини, що виводяться з розчину.
Наприклад, під час гідролізу алюміній сульфіду утворюються нерозчинний алюміній гідроксид та леткий сірководень:
Al2S3 + 6H2O → 2Al(OH)3↓ + 3H2S↑
Обидві речовини виводяться з розчину, і, згідно з принципом Ле Шательє, це сприяє зміщенню рівноваги в бік продуктів реакції. У такому випадку реакція гідролізу є необоротною. Необоротний гідроліз характерний для солей, під час гідролізу яких обидва продукти реакції виводяться з розчину (у вигляді газуватої або нерозчинної речовини) і не здатні вступати у зворотну реакцію. Зазвичай ці солі в таблиці розчинності позначені як такі, що не існують у розчині або розкладаються водою (див. форзац).
Окремими випадками необоротного гідролізу є взаємодія алюміній або кальцій карбіду з водою:
CaC2 + 2H2O → Ca(OH)2 + C2H2↑
Al4C3 + 12H2O → 4Al(OH)3↓ + 3CH4↑
У цьому випадку і етин, і метан можна розглядати як дуже слабкі леткі кислоти, тому ці взаємодії можна віднести до процесів необоротного гідролізу.
1. Який вихід продукту реакції називають практичним, а який — теоретичним?
- Практичний вихід — це кількість речовини, маса або об’єм продукту реакції, одержаних практично.
- Теоретичний вихід — це кількість речовини, маса або об’єм - продукту реакції, обчислених за рівнянням реакції.
2. Як обчислити практичний вихід речовини?
Застосовуємо.
1.Обчисліть відносний вихід гідроген хлориду, якщо з хлору кількістю речовини 5 моль одержали гідроген хлорид масою 340 г.
Дано: v(Cl2)=5 моль, mпрактична(HCl)=340 г
Розв'язок:
Рівняння реакції: H2 + Cl2 = 2HCl
За рівнянням реакції: v(Cl2) / v(HCl)=1/2, тому v(HCl)=2 • v(Cl2) = 2 • 5 моль =10 моль
M(HCl) = 36,5 г/моль
Тоді:
mтеоретична(HCl)=v(HCl) • M(HCl) = 10 • 36,5 = 365 г
η = mпрактична(HCl) / mтеоретична(HCl) = (340 / 365) • 100 = 93,15%
2. У 10 класі ви вивчали один із способів добування етину — карбідний. Обчисліть:
а) масу кальцій карбіду СаС2, добутого із вугілля масою 72 г і достатньої кількості кальцій оксиду за схемою: СаО + 3С → СаС2 + СО, якщо його відносний вихід дорівнював 80 %;
Дано: mпрактична(C )= 72 г, η = 80%. Треба знайти mпрактична(CaC2)
Розв'язок:
v(C)=m(C):M(C)=72 г : 12 г/моль=6 моль
Рівняння реакції: СaO + 3C → CaC2 + CO
За рівнянням реакції: v(C) / v(CaC2) = 3/1, тому v(CaC2) = v(C) / 3= 6/3 = 2 моль
M(CaC2) = 64 г/моль
mтеоретична(CaC2)=v(CaC2) • M(CaC2) = 2 • 64 = 128 г
mпрактична(CaC2)=η • mтеоретична(CaC2) / 100% = 80 • 128 / 100% =102,4 г
б) відносний вихід етину, добутого з одержаного кальцій карбіду, якщо об'єм вуглеводню становить 33,6 л (н. у.)
Дано: m(CaC2) = 102,4 г, V(C2H2) = 33.6 л. Потрібно знайти η.
Розв'язок:
v(CaC2) = m(CaC2) / M(CaC2) = 102,4 / 64 =1,6 моль
Рівняння реакції: СaC2 + 2H2O → C2H2 + Ca(OH)2
За рівнянням реакції v(CaC2) / v(C2H2) = 1/1, тому v(C2Н2) = v(CаС2) = 1,6 моль
V(C2H2) = v(C2H2) • Vm = 1,6 • 22,4 = 35,84 л
η = Vпрактичний(С2Н2) / Vтеоретичний(С2Н2) = (33,6 / 35,84) • 100 = 93,75%
3. Обчисліть відносний вихід негашеного вапна масою 400 г, добутого термічним розкладом кальцій карбонату масою 800 г.
Дано: mпрактична(CаО) = 400 г, m(CaCO3) = 800 г. Треба знайти η.
Розв'язок:
M(CaCO3) = 100 г/моль
v(CaCO3) = m(CaCO3) / M(CaCO3) = 800 /100 = 8 моль
Рівняння реакції: СaСO3→ СaO + CO2↑
За рівнянням реакції v(CaCO3) / v(CaO) = 1/1, тому v(CaO) = v(CaCO3) = 8 моль
M(CaO)=56 г/моль
mтеоретична(CaO) = v(CaO) • M(CaO) = 8 моль• 56 г/моль = 448 г
η =mпрактична(СaO) / mтеоретична(СaO) = (400 / 448) 100 = 89,28%
4. Унаслідок взаємодії натрію кількістю речовини 0,2 моль з водою добули водень об'ємом 1,916 л (н. у.). Обчисліть відносний вихід продукту реакції.
Дано: v(Na) = 0,2 моль, Vпрактичний(H2) = 1,916 л. Потрібно знайти η.
Розв'язок:
Рівняння реакції: 2Na + 2H2O → 2NaOH + H2
За рівнянням реакції v(Na) / v(H2) = 2/1, тому v(H2) = v(Na) / 2 = 0,2/2 =0,1 моль
Vтеоретичний(H2) = v(H2) • Vm = 0,1 • 22,4 = 2,24 л
η = Vпрактичний(H2) / Vтеоретичний(H2) = (1,916 / 2,24) • 100 = 85,53%
5. Відновленням ферум(ІІІ) оксиду масою 3,2 т добули залізо масою 1,786 т. Обчисліть відносний вихід металу
Дано: mпрактична(Fe) = 1,786 т, mтеоретична (Fe2O3) = 3,2 т
Розв'язок:
M(Fe2O3) = 26 • 2 + 8 • 3 = 160 г/моль
M(2Fe) = 112 г/моль
mтеоретична(Fe) = 3,2 • 112/160 = 2,24 т
η = mпрактична(Fe) / mтеоретична(Fe2O) = (1,786 / 2,24) • 100 = 79,73 %
Хімічна рівновага. Вам уже відомо, що під час оборотних реакцій речовини не витрачаються повністю. Утворені продукти знову взаємодіють між собою за тих самих умов. Наприклад, взаємодія сульфур(IV) оксиду з киснем за температури 450 °С та наявності каталізатора одночасно відбувається у двох напрямках, тобто здійснюються пряма й зворотна реакції:
2SO2 + O2 ⇄ 2SO3.
Під час перебігу прямої реакції концентрація реагентів зменшується, оскільки вони витрачаються на утворення продуктів. Однак настає момент, коли концентрація продуктів реакції різко зростає, а швидкості прямої та зворотної реакцій стають однаковими, тобто зрівноважуються. Такий стан системи називають хімічною рівновагою.
Зазначимо, що в стані рівноваги хімічні реакції не припиняються. Це означає, що за одиницю часу кількість молекул, що утворюються під час прямої реакції, дорівнює кількості молекул, що утворюються під час зворотної (рис. 29).

Рис. 29. Схема прямої та зворотної реакцій
• Хімічна рівновага — це стан системи, коли швидкість прямої реакції зрівноважується зі швидкістю зворотної реакції.
Умови зміщення хімічної рівноваги оборотних процесів. Стан хімічної рівноваги є збитковим у хімічному виробництві. Тому вчені розпочали пошук способів зміщення рівноваги в бік продуктів реакції. До чинників, що впливають на зміщення рівноваги, належать зміни температури, тиску та концентрації. Ознайомимося докладніше, як ці чинники діють на зміщення хімічної рівноваги.
Вплив зміни температури. Певну історію має промислове виробництво амоніаку з азоту та водню. Ця реакція екзотермічна, тому під час реакції виділяється теплота. Рівняння реакції:
N2 + 3H2 ⇄ 2NH3, ΔΗ = -92 кДж/моль.
Очевидно, що процес розкладу амоніаку (зворотна реакція) є ендотермічним. Тому з підвищенням температури рівновага реакції зміститься в бік розкладу амоніаку, оскільки процес супроводжується поглинанням теплоти. Це протидіє підвищенню температури. Тож для зміщення рівноваги в бік виходу амоніаку суміш реагентів необхідно охолоджувати.
Отже, підвищення температури зміщує хімічну рівновагу в бік ендотермічної реакції, зниження температури — у бік екзотермічної.
Вплив зміни тиску. На стан хімічної рівноваги газоподібних речовин впливає тиск. Розглядаючи в цьому аспекті реакцію добування амоніаку, бачимо, що з чотирьох об'ємів газів, що вступали в реакцію, утворюється два об'єми амоніаку. Підвищення тиску зміщує рівновагу в бік прямої реакції і, відповідно, відбувається зниження тиску в системі.
Отже, підвищення тиску зміщує хімічну рівновагу в бік, що зумовлює зменшення об'єму, а зниження тиску — у бік збільшення об'єму речовин, що реагують.
Вплив зміни концентрації. Зміна концентрації однієї з речовин, що перебувають у стані хімічної рівноваги, зумовлює зміщення рівноваги в бік зменшення концентрації. Наприклад, розглянемо реакцію естерифікації, що є оборотною:

Якщо збільшити концентрацію етанової кислоти або етанолу, то рівновага зміститься в бік утворення естеру. Другий спосіб зміщення рівноваги в бік утворення продукту — забрати із системи один з продуктів реакції (наприклад, воду).
Отже, додавання в систему, що перебуває в стані хімічної рівноваги, одного з реагентів зміщує рівновагу в бік утворення продуктів реакції. Такий самий ефект отримують, якщо вивести із системи один з продуктів реакції. Якщо ж збільшувати концентрацію одного з продуктів, то реакція зміщується в бік реагентів.
Вплив зовнішніх чинників на стан хімічної рівноваги визначають за правилом, яке було сформульоване в 1884 р. А. Л. Ле Шательє та дістало назву принцип Ле Шательє.
• Якщо на систему, що перебуває в стані хімічної рівноваги, подіяти ззовні (змінити температуру, тиск або концентрацію), то рівновага зміститься в бік, протилежний створеній умові.

Анрі Луї Ле Шательє (1850-1936) — французький фізик і хімік. Навчався в колежі Роллан у Парижі, Політехнічній школі та Вищій гірничій школі. Одночасно слухав лекції в Колеж де Франс. Після закінчення Вищої гірничої школи працював гірничим інженером в Алжирі. З 1877 по 1919 р. був професором Вищої гірничої школи в Парижі, у 1898-1907 рр. — професором кафедри загальної хімії в Колеж де Франс, у 1907-1925 рр. — професором Паризького університету. У 1907 р. був обраний членом Паризької академії наук.
Більшість робіт Ле Шательє присвячена прикладним проблемам. У 1884 р. сформулював принцип (названий його ім'ям), який використовується для моделювання різних виробничих процесів. У 1901 р. запропонував умови для промислового синтезу амоніаку. За активної участі вченого фізична хімія й хімічна технологія перетворилися на самостійні галузі науки. За свою наукову діяльність був удостоєний багатьох почесних нагород.
Використання каталізаторів не впливає на зміщення хімічної рівноваги, тому що вони однаково пришвидшують пряму й зворотну реакції.
Значення принципу Ле Шательє. Принцип Ле Шательє має вагоме значення в хімічному виробництві. Він дає змогу передбачити напрямок перебігу хімічної реакції за різних умов і, отже, керувати виробничими процесами.
Принцип Ле Шательє важливий для процесів, що відбуваються в біосфері. Вам уже відомо, що біологічно активні речовини постійно циркулюють у біосфері, тобто здійснюється її саморегуляція. Вона підтримується завдяки природним біологічним процесам живих організмів. Принцип Ле Шательє пояснює стійкість довкілля так: усі геофізичні й космічні зміни компенсуються змінами у функціонуванні живих організмів. Ці організми разом з довкіллям формують біосферу нашої планети. Зміни природних біологічних процесів, пов'язаних з живими організмами, призводять до порушення умов навколишнього середовища. Отже, кожна людина повинна пам'ятати, що втручання в природні процеси довкілля може спричинити відповідні екологічні незворотні наслідки на шкоду самій людині.
https://youtu.be/Dgfgi2kcOnc
ПІДСУМОВУЄМО ВИВЧЕНЕ
• Хімічна рівновага — стан системи, коли швидкість прямої реакції зрівноважується зі швидкістю зворотної реакції.
• На стан хімічної рівноваги впливають зміни температури, тиску, концентрації.
• Підвищення температури зміщує хімічну рівновагу в бік ендотермічної реакції, зниження температури — у бік екзотермічної.
• Для газів підвищення тиску зміщує рівновагу в бік, що спричиняє зменшення об'єму, а зниження — у бік збільшення об'єму речовин, що реагують.
• Додавання в систему, що перебуває в стані хімічної рівноваги, одного з реагентів зміщує рівновагу в бік утворення продуктів реакції. Ефект буде такий самий, якщо вивести із системи один з продуктів реакції. Якщо ж збільшувати концентрацію одного з продуктів, то реакція зміститься в бік реагентів.
- випадає осад:
- виділяється газ:
- утворюється слабкий електроліт (наприклад, вода):
- виділяється велика кількість енергії:
Донорно-акцепторний механізм утворення ковалентного зв’язку.
Розглянемо його утворення на прикладі катіона амонію NH4+
NH3 + НCl = NH4Cl (амоній хлорид)
У реакції катіон Гідрогену, утворений унаслідок дисоціації хлоридної кислоти, приєднався до молекули амоніаку й утворився амоній-катіон NH4+.
NH3 + H+ + Cl– = NH4+ + Cl–
Амоній-катіон — це однозарядний позитивний йон NH4+, що утворюється внаслідок приєднання Гідроген-катіону до молекули амоніаку. Утворення амоній-катіону відбувається за допомогою ковалентного зв’язку, але його механізм особливий — донорно-акцепторний. Щоб зрозуміти цей механізм, розглянемо електронну формулу молекули амоніаку:
Як свідчить електронна формула, за рахунок трьох неспарених електронів Нітроген утворив три ковалентні полярні зв’язки з трьома атомами Гідрогену. Усі атоми молекули амоніаку досягли завершення зовнішніх енергетичних рівнів. В атома Нітрогену він складається з восьми електронів, у атомів Гідрогену — з двох.
Електронегативність Гідрогену дорівнює 2,1; Нітрогену — 3,5. Тому спільні електронні пари зміщені до більш електронегативного Нітрогену. Цим пояснюється полярність утворених ковалентних зв’язків. Зверніть увагу, що серед чотирьох електронних пар атома Нітрогену в молекулі амоніаку одна є особливою в тому сенсі, що утворена не вна-
слідок взаємодії з атомом Гідрогену. За походженням — це ті два спарені s-електрони зовнішнього енергетичного рівня атома Нітрогену, що є в нього на 2s-підрівні:
Катіон Гідрогену Н+, що утворюється внаслідок електролітичної дисоціації гідроген хлориду в розчині, має вільну електронну орбіталь . За рахунок неї та вільної електронної пари Нітрогену утворюється ще один ковалентний зв’язок. У його утворенні Нітроген виступив донором електронів (надав свою вільну електронну пару катіону Гідрогену), а каті-
он Гідрогену став акцептором — її приймачем. Утворився катіон амонію
Як видно з малюнка , у катіоні амонію чотири ковалентні зв’язки, з яких три утворені спільними електронними парами, а один — за донорно-акцепторним механізмом.
Ковалентний зв’язок може виникати між двома атомами, один з яких має пару електронів, а другий — вакантну (незаповнену електронами) орбіталь. Такий механізм утворення ковалентного зв’язку називається донорно-акцепторним. Атом, який надає власну (вільну) електронну пару, називається донором, а атом, який має вільну
орбіталь, називають акцептором.
Водневий зв’язок.
Ознайомтесь з утворенням водневого зв’язку між молекулами води(1) та молекулами спиртів (2)
Водневий зв’язок — це зв’язок між атомом Гідрогену, що зв’язаний з сильно електронегативним атомом (F, O, N) і має частково позитивний заряд, й іншим електронегативним атомом (Флуору F, Оксигену О, Нітрогену N) цієї чи іншої молекули.
В обох прикладах розглянуто міжмолекулярний водневий зв’язок. Існує також внутрішньомолекулярний водневий зв’язок, який забезпечує «зв’язування» окремих частин однієї молекули. Внутрішньомолекулярний зв’язок існує в білкових молекулах, ним зумовлена їхня вторинна структура . Утворення подвійної спіралі ДНК частково відбува-
ється завдяки водневим зв’язкам.
Водневий зв’язок слабкіший за йонний і ковалентний, але він відіграє важливу роль у фізіологічних і біохімічних процесах, що відбуваються в організмах.
Утворюється одна спільна електронна пара, яка зміщена до атома Хлору. У результаті з'являються часткові заряди: на атомі Хлору — негативний, а на атомі Гідрогену — позитивний. Зміщення електронної густини прийнято позначати грецькою літерою дельта
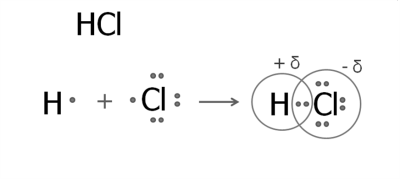
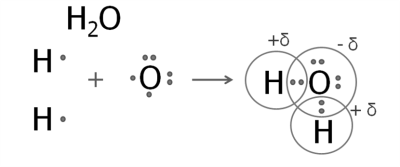
Атом Нітрогену приєднує до себе три атоми Гідрогену.
Нітроген — більш електронегативний елемент, тому на його атомі буде негативний заряд, а на атомах Гідрогену — позитивні заряди.
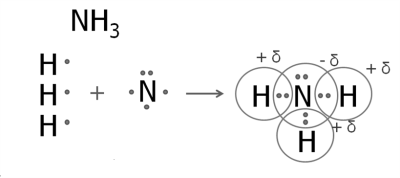
Йонний зв'язок
• Хімічний зв'язок, що реалізується за рахунок притягання протилежно заряджених йонів, називають йонним.
Йонний зв'язок існує в речовинах, утворених металічними та неметалічними елементами. Така речовина може утворитися, наприклад, під час взаємодії металу з неметалом.
Йонний зв'язок:
• виникає між протилежно зарядженими йонами;
• існує між одно- та багатоатомними йонами в солях, гідроксидах та деяких оксидах металічних елементів
Йонний зв'язок зумовлений наявністю в речовині вільних йонів (катіонів та аніонів). Катіони можуть утворитися з атомів металічних елементів у разі втрачання електронів, а аніони — з атомів неметалічних, що приймають електрони. Аніони також можуть утворитися з молекул кислот під час електролітичної дисоціації. Між різнойменно зарядженими йонами виникає електростатичне притягання, причому сила притягання залежить від зарядів йонів та їхніх радіусів.
Класичним прикладом утворення речовини з йонним зв'язком є хімічна взаємодія натрію та хлору, під час якої утворюються катіони Натрію Na+ та хлорид-іони Cl-:
2Na + Cl2 = 2NaCl
Na0 - e- → Na+
Cl0 + e- → Cl-
Атом Натрію віддає електрон атому Хлору. При цьому обидва атоми перетворюються на йони з електронною конфігурацією атомів інертного елемента.
У натрій хлориді, що утворився, містяться катіони Натрію та хлорид-аніони. У кристалі вони між собою не зв'язані жорстко, а утримуються разом завдяки притяганню між протилежно зарядженими йонами (мал. 5.2).

Мал. 5.2. У кристалі натрій хлориду йони утримуються йонним зв'язком
Розглянемо інший приклад: взаємодію магнію з розбавленою сульфатною кислотою. Під час реакції атоми Магнію віддають два електрони і перетворюються на йони Магнію Mg2+. Окисником у цій реакції є йони Гідрогену, які приймають електрони і перетворюються на атоми Гідрогену, а сульфат-іони змін не зазнають:
Mg + H2SO4 = MgSO4 + H2↑
Mg0 - 2e- → Mg2+
2H+ + 2e- → 2H0 → H2↑

Під час реакції магнію із сульфатною кислотою частинки обмінюються електронами
Якщо випарити воду після проведення такого досліду, то залишиться кристалічна речовина — магній сульфат, що складається з йонів Магнію та сульфат-іонів, сполучених йонним зв'язком (мал. 5.3).

Мал. 5.3. Магній сульфат — речовина з йонним зв'язком
Отже, йонний зв'язок характерний для солей, а також для інших сполук, у яких існують йони: основних оксидів та лугів.
Д.З. Перегляньте відеоматеріали; вивчить матеріал підручника і сайту.
• Електронна оболонка атома складається з електронів. Їх кількість, як і кількість протонів, визначається протонним числом (порядковим, атомним номером) хімічного елемента.
• Електрон має двоїсту природу. Він наділений властивостями мікрочастинки й хвилі. Через це неможливо простежити всі етапи його руху в атомі, можна лише передбачити ймовірність його перебування в тій чи іншій точці атомного простору.
• s-Електрони — це електрони зі сферичною формою орбіталі.
• р-Електрони — це електрони з формою орбіталі, схожою на гантель чи об'ємну вісімку.
• Відповідно до форми електронних орбіталей розрізняють s-, p-, d-, f-електрони.
• Електрони з приблизно однаковою величиною енергії утворюють один енергетичний рівень.
• У межах одного енергетичного рівня електрони з однаковою формою електронної орбіталі утворюють енергетичний підрівень.
• Валентні електрони — електрони, які беруть участь в утворенні хімічних зв'язків.
• Енергетичні рівні, заповнені максимально можливою для них кількістю електронів, називають завершеними. Енергетичні рівні з меншою за максимальну кількістю електронів — незавершеними.
У 8 класі ви вже мали справу з електронними й графічними електронними формулами. Пригадайте, що:
електронна формула атома — це запис розподілу електронів в електронній оболонці атома, де коефіцієнтами позначають енергетичні рівні (1, 2, ... 7), символами — підрівні (s, p, d, f), верхніми індексами — кількість електронів на підрівнях. Наприклад, електронна формула атома Силіцію 14Si така: 1s22s22p63s23p2.
ГРАФІЧНІ ЕЛЕКТРОННІ ФОРМУЛИ доповнюють інформацію про будову електронної оболонки атома відомостями про кількість енергетичних комірок (кожну комірку позначають квадратиком) та заповнення їх електронами. Два спарені електрони однієї комірки позначають двома протилежно спрямованими стрілками ⇅, неспарений електрон — однією ↑. Протилежно спрямовані стрілочки вказують на те, що спарені електрони обертаються навколо своєї осі в протилежних напрямках.
Графічна електронна формула атома — відображення розподілу електронів за енергетичними комірками.
Приклад графічної електронної формули наведено на малюнку 1.

Мал. 1. Графічна електронна формула атома Силіцію
ЩО СЛІД ПАМ'ЯТАТИ ПІД ЧАС СКЛАДАННЯ ЕЛЕКТРОННИХ І ГРАФІЧНИХ ЕЛЕКТРОННИХ ФОРМУЛ. Складати електронні та графічні електронні формули атомів допоможе вам наведена нижче інформація, частину якої вам достатньо буде лише пригадати з курсу хімії 8 класу.
У межах одного рівня кількість підрівнів визначається кількістю наявних форм орбіталей.
На першому енергетичному рівні перебувають електрони лише зі сферичною формою орбіталей, тобто s-електрони, вони утворюють s-шдрівень. Отже, на першому енергетичному рівні існує один підрівень.
На другому енергетичному рівні розміщені електрони зі сферичною та гантелеподібною формами орбіталей, тобто s- та p-електрони. Відповідно до цього другий рівень включає два підрівні — s-підрівень та р-підрівень. (Назви підрівнів повторюють назви орбіталей.)
На третьому енергетичному рівні є три підрівні: s-, p-, d-. Тобто, з'являється d-підрівень. Його заповнення d-електронами відбувається в атомів хімічних елементів з протонними числами 21-30 (атоми хімічних елементів четвертого періоду).
Четвертий підрівень називається — f-підрівнем і з'являється він на четвертому енергетичному рівні у хімічного елемента Церію (протонне число 58).
Оскільки s-підрівень містить лише одну s-орбіталь, то на ньому можливе перебування не більше двох s-електронів. р-Підрівень містить три р-орбіталі, тому на ньому може перебувати максимально шість р-електронів. На d-підрівні налічується п'ять орбіталей, тож максимальне число d-електронів на ньому — десять. Щоб заповнити сім орбіталей f-підрівня, знадобиться чотирнадцять f-електронів.
На малюнку 2 наведено графічні зображення орбіталей перших чотирьох енергетичних рівнів.

Мал. 2. Структура перших чотирьох енергетичних рівнів
Те, що на підрівні вдвічі більше електронів, ніж орбіталей, пояснюється існуванням спарених електронів.
ПРИНЦИП «МІНІМАЛЬНОЇ ЕНЕРГІЇ», АБО ПРАВИЛО МІНІМУМУ ЕНЕРГІЇ. За сучасною теорією будови атома заповнення електронних оболонок атомів хімічних елементів підлягає таким загальним правилам.
Спочатку в атома електронами заповнюється перший енергетичний рівень, потім другий, і тільки після остаточного заповнення другого енергетичного рівня розпочинається заповнення третього рівня.
У межах одного енергетичного рівня першим заповнюється s-підрівень, після чого розпочинається заповнення р-підрівня.
Зазначені правила — наслідок дії принципу «мінімальної енергії». Цей принцип полягає в тому, що електрон в електронній оболонці атома за можливості займає енергетично найбільш вигідну орбіталь. З двох орбіталей енергетично вигіднішою для конкретного електрона є орбіталь з мінімальною енергією. Наприклад, атом Бору має п'ять електронів. Елемент розташований у другому періоді, тож його електронна оболонка має два енергетичні рівні. Перший рівень складається з одного підрівня — s-підрівня, а от другий рівень окрім s-підрівня має ще й р-підрівень. Сумарно обидва рівні налічують п'ять енергетичних комірок. Здавалося б, є можливість кожному з п'яти електронів розміститись в окремій комірці. Але це не так. Згідно з принципом «мінімальної енергії» повністю заповняться електронами s-підрівні обох енергетичних рівнів, і тільки один електрон розміститься на р-підрівні. Тож електронна й графічна електронна формули атома Бору будуть такими:
![]()
СКЛАДАННЯ ЕЛЕКТРОННИХ І ГРАФІЧНИХ ЕЛЕКТРОННИХ ФОРМУЛ АТОМІВ. В основній школі вам неодноразово доводилося складати електронні формули атомів. Застосуйте набуті знання й інформацію цього параграфа та виконайте завдання рубрики «Попрацюйте групами».
Пам'ятайте, що складаючи електронні й графічні електронні формули, спершу на кожному енергетичному підрівні в кожній енергетичній комірці позначають по одному електрону ↑. Якщо вільних комірок не залишається, то позначають по два ⇅.
Д.З. Опрацюйте матеріал сайту і підручника, виконайте завдання:
Завдання 1. Складіть електронні й графічні електронні формули атомів хімічних елементів другого періоду.
Завдання 2. Дотримуючись принципу «мінімальної енергії», складіть електронну й графічну електронну формули атома, електронна оболонка якого має шість s-електронів і сім р-електронів. Назвіть елемент, дайте йому характеристику за місцем у періодичній системі.
Завдання 3. Знайдіть і виправте помилки в електронних формулах атомів:
а) 1s22s12p4;
б) 1s12s2;
в) 1s22s12p7.



Немає коментарів:
Дописати коментар